解答题-结构与性质 适中0.65 引用1 组卷262
含ⅥA族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)基态O原子电子占据最高能级的电子云轮廓图为_______ 形。
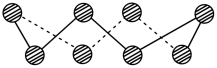
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是_______ 。
(3)Se的核外M层电子的排布式为_______ 。
(4)关于物质I~Ⅳ,下列说法正确的有_______ 。
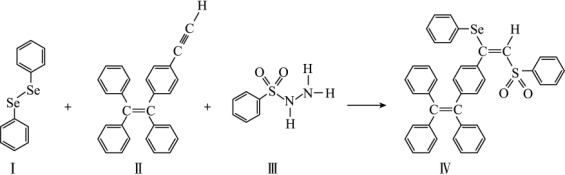
A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是_______ 。
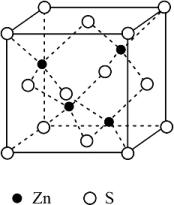
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有_______ 个。晶胞棱长为apm,密度为_______ gcm3(NA表示阿伏加德罗常数的值)。
(1)基态O原子电子占据最高能级的电子云轮廓图为
(2)S单质的常见形式为S8,其环状结构如图所示,S原子的杂化轨道类型是

(3)Se的核外M层电子的排布式为
(4)关于物质I~Ⅳ,下列说法正确的有

A.I中仅有σ键
B.I中的Se-Se键为非极性共价键
C.I易溶于水
D.II中碳原子的杂化轨道类型只有sp与sp2
E.I~Ⅳ含有的元素中,O电负性最大
(5)常温下CO2是气体而CS2是液体的原因是
(6)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

22-23高三上·天津河西·期末
类题推荐
I.请根据下列相关信息,回答问题。
(1)请把B以及B同周期且原子序数比B小的原子按第一电离能从大到小的顺序排列:______ (用相应的元素符号表示);A、D两种元素中,电负性A______ D(填“>”或“<”)。
(2)基态B原子的价电子排布图为______ ,占据最高能级的电子云轮廓图形状为______ 。
(3)C的最高价含氧酸根离子的空间构型为______ ,中心原子杂化轨道类型为______ 。
(4)元素E与镍的第二电离能分别为:I2(E)=1959kJ/mol,I2(Ni)=1753kJ/mol,从原子结构知识解释I2(E)>I2(Ni)的原因是______ 。
Ⅱ.回答下列问题:
(5)第四周期的金属钴及其化合物在工业上有重要用途。请回答下列问题:
①基态Co原子的核外电子占据的最高能层符号为______ 。
②下列状态的钴中,电离最外层一个电子所需能量最大的是______ (填标号)。
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。该配合物的一种配体是NH3,NH3的空间结构呈______ 形,是______ (填“极性”或“非极性”)分子。
(6)根据第VA族元素及其化合物的结构和性质回答:
①N原子的基态原子核外电子排布式为______ 。
②NH3、PH3、AsH3的沸点由高到低的顺序为______ (填化学式,下同),键角由大到小的顺序为______ 。
(7)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有______ 个,晶胞棱长为apm,密度为______ g•cm-3(NA表示阿伏加德罗常数的值,以含a、NA的代数式表示)。

| A | 基态原子最外层电子数是次外层的三倍 |
| B | 基态原子核外有13种不同运动状态的电子 |
| C | 与B同一周期,原子中未成对电子数是同周期中最多 |
| D | D2-的核外电子排布与氩原子相同 |
| E | 是ds区原子序数最小的元素 |
(2)基态B原子的价电子排布图为
(3)C的最高价含氧酸根离子的空间构型为
(4)元素E与镍的第二电离能分别为:I2(E)=1959kJ/mol,I2(Ni)=1753kJ/mol,从原子结构知识解释I2(E)>I2(Ni)的原因是
Ⅱ.回答下列问题:
(5)第四周期的金属钴及其化合物在工业上有重要用途。请回答下列问题:
①基态Co原子的核外电子占据的最高能层符号为
②下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
③[Co(NH3)5Cl]Cl2是Co3+的一种重要配合物。该配合物的一种配体是NH3,NH3的空间结构呈
(6)根据第VA族元素及其化合物的结构和性质回答:
①N原子的基态原子核外电子排布式为
②NH3、PH3、AsH3的沸点由高到低的顺序为
(7)立方ZnS晶体结构如图所示,S周围紧邻且等距的Zn有

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网