解答题-原理综合题 较易0.85 引用2 组卷209
化学反应是人类获得能量的重要途径。请结合所学知识解决以下问题。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
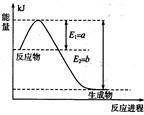
(1)如图是 和
和 反应生成
反应生成 的过程中能量变化示意图,请写出
的过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式_______ 。
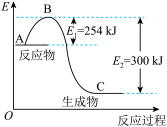
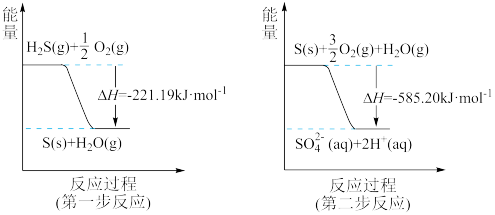
(2)用 催化还原NO,还可以消除氮氧化物的污染。已知:
催化还原NO,还可以消除氮氧化物的污染。已知:

 ①
①

 ②
②
若 还原NO至
还原NO至 ,则该反应过程中的反应热
,则该反应过程中的反应热
____ kJ/mol(用含a、b的式子表示)。
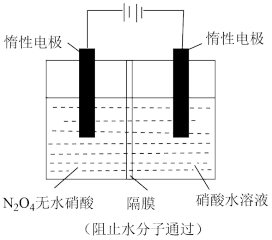
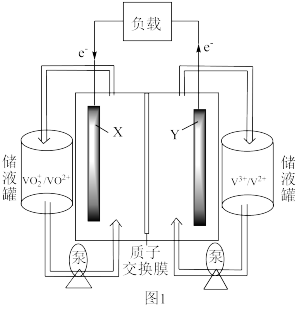
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
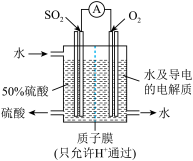
(3)通入 的电极为
的电极为_______ 极,其电极反应式为_______ 。
(4)电解质溶液中的 通过质子膜
通过质子膜_______ 移动(填“向左”、“向右”或“不”)。
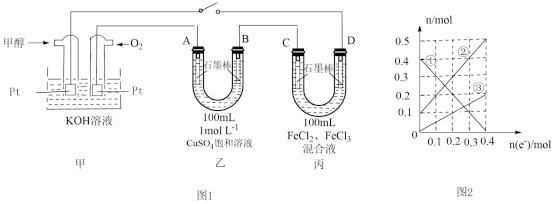
III.用石墨棒作电极,在 、
、 、
、 、
、 等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
等离子中选出适当离子组成电解质,电解其溶液,写出符合条件的一种电解质的化学式:
(5)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ (写化学式,下同)。
(6)当阴极放出 ,阳极放出
,阳极放出 时,电解质是
时,电解质是_______ 。
(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是_______ 。
I.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)如图是

(2)用
若
II.某科研单位利用电化学原理用来制备硫酸,装置如图所示。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。

(3)通入
(4)电解质溶液中的
III.用石墨棒作电极,在
(5)当阴极放出
(6)当阴极放出
(7)通过电子的物质的量与阴极析出的金属的物质的量、阳极放出的气体的物质的量之比为4∶2∶1时,电解质是
22-23高二上·天津河西·期末
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网