解答题-实验探究题 适中0.65 引用1 组卷283
三氯乙醛(CCl3CHO)是无色油状液体,是制取农药的常用原料。某探究小组模拟工业生产制备三氯乙醛的实验装置如图所示(夹持、加热装置均略去)。
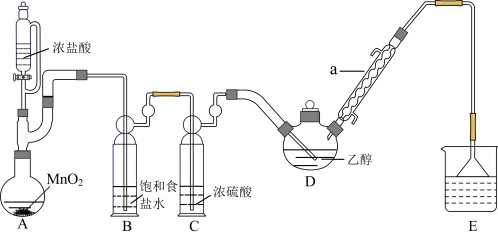
查阅资料知:①制备CCl3CHO的反应原理为: ,可能发生的副反应有:
,可能发生的副反应有: ;
; 。
。
②有关物质的性质:
回答下列问题:
(1)装置A中发生反应的离子方程式为_______ ,仪器a的作用是_______ 。
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是_______ ,若发现D中导管口处气泡速率过快,合理的解决方法是_______ 。
(3)若撤去装置C会导致CCl3CHO产率降低,原因是_______ 。
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是_______ 。
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应: 、
、 充分进行;
充分进行;
Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应: ;
;
Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为_______ ,下列情况可能导致产品纯度的测量值偏小的是_______ (填标号)。
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低

查阅资料知:①制备CCl3CHO的反应原理为:
②有关物质的性质:
| 物质 | C2H5OH | CCl3 CHO | CCl3COOH | C2H5Cl |
| 熔点/℃ | -114.1 | -57.1 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水、可溶于乙醇 |
(1)装置A中发生反应的离子方程式为
(2)实验时,应维持装置D的反应温度为70℃左右,装置D采用较合理的加热方式是
(3)若撤去装置C会导致CCl3CHO产率降低,原因是
(4)从反应后的混合物中获得CCl3CHO粗产品,应采取的实验操作方法是
(5)粗产品纯度的测定:
Ⅰ.称取m g CCl3CHO(相对分子质量为147.5)粗产品,配成待测溶液,然后用酸式滴定管量取xmL0.100mol·L-1碘标准溶液加入待测溶液,再加入适量碳酸钠溶液,使反应:
Ⅱ.再加适量盐酸调节溶液的pH,并立即用0.020mol·L-1Na2S2O3溶液滴定至终点,发生反应:
Ⅲ.重复上述操作3次,平均消耗Na2S2O3溶液ymL。测得产品的纯度为
a.量取碘标准液时,酸式滴定管未用碘标准液润洗
b.在滴定终点读数时,俯视标准液液面
c.Na2S2O3溶液部分被氧化
d.步骤Ⅱ加入盐酸调节溶液pH,调节后溶液pH过低
22-23高三上·山东潍坊·期末
类题推荐
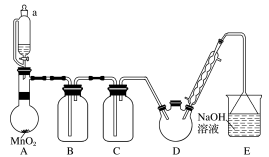
某探究小组模拟制备三氯乙醛(CCl3CHO)的实验装置如图(夹持、加热装置均已略去)。
Ⅰ.制备原理: 。
。
可能发生的副反应:ⅰ. ;
;
ⅱ. 。
。
Ⅱ.相关物质的相对分子质量及部分物理性质如表所示:
回答下列问题:
(1)装置A中发生反应的离子方程式为______ ,仪器m中水流的出口为______ (填“a”或“b”)。
(2)装置B中盛装的试剂为饱和食盐水,若撤去装置C,会导致CCl3CHO的产率降低,试分析可能原因:______ 。
(3)装置D处宜采用的加热方法为______ (填“直接加热”或“水浴加热”);若实验结束后装置E中溶液含有的含氯元素的阴离子仅有ClO-和X,检验阴离子X的方法为______ 。
(4)称取0.40g制得的产品,配成待测溶液,向待测液中加入适量NaOH溶液,再用滴定管向待测溶液中加入30.00mL 碘标准溶液,使反应
碘标准溶液,使反应 ,
, 充分进行。完全反应后,加盐酸调节溶液的pH,加入淀粉溶液作指示剂,并立即用
充分进行。完全反应后,加盐酸调节溶液的pH,加入淀粉溶液作指示剂,并立即用 的Na2S2O3溶液滴定过量的I2至终点,发生反应:
的Na2S2O3溶液滴定过量的I2至终点,发生反应: 。
。
重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
①取用碘标准溶液和Na2S2O3溶液所用滴定管分别为______ (填标号)。
a.酸式滴定管、酸式滴定管 b.碱式滴定管、碱式滴定管
c.酸式滴定管、碱式滴定管 d.碱式滴定管、酸式滴定管
②实验到达滴定终点的现象是______ ,测得产品的纯度为______ (保留三位有效数字)。
③若取用碘标准溶液的滴定管用蒸馏水洗净后没有用碘标准溶液润洗,则测定结果将______ (填“偏大”“偏小”或“不变”)。

Ⅰ.制备原理:
可能发生的副反应:ⅰ.
ⅱ.
Ⅱ.相关物质的相对分子质量及部分物理性质如表所示:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)装置A中发生反应的离子方程式为
(2)装置B中盛装的试剂为饱和食盐水,若撤去装置C,会导致CCl3CHO的产率降低,试分析可能原因:
(3)装置D处宜采用的加热方法为
(4)称取0.40g制得的产品,配成待测溶液,向待测液中加入适量NaOH溶液,再用滴定管向待测溶液中加入30.00mL
重复上述操作3次,平均消耗Na2S2O3溶液20.00mL。
①取用碘标准溶液和Na2S2O3溶液所用滴定管分别为
a.酸式滴定管、酸式滴定管 b.碱式滴定管、碱式滴定管
c.酸式滴定管、碱式滴定管 d.碱式滴定管、酸式滴定管
②实验到达滴定终点的现象是
③若取用碘标准溶液的滴定管用蒸馏水洗净后没有用碘标准溶液润洗,则测定结果将
某探究小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
(1)仪器A中发生反应的化学方程式为:______ 。
(2)装置B中的试剂是______ ,若撤去装置B,可能导致装置D中副产物______ (填化学式)的量增加;装置D可采用______ 加热的方法控制反应温度在70℃左右。
(3)装置D中球形冷凝管的作用为______ 。写出E中所有可能发生的无机反应的离子方程式:______ 。
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为______ 。(计算结果保留三位有效数字)
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O;CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(2)装置B中的试剂是
(3)装置D中球形冷凝管的作用为
(4)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol·L-1碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol·L-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
滴定的反应原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O
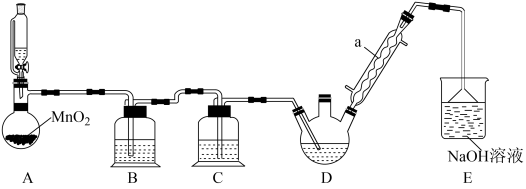
某探究小组模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验,实验装置如图所示(夹持、加热仪器略)。
查阅资料,有关信息如下。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
回答下列问题:
(1)仪器a的名称是_______ ,作用是_______ 。
(2)装置A中发生反应的化学方程式为_______ 。装置B中的试剂是_______ 。
(3)装置D可采用_______ 加热的方法以控制反应温度在70℃左右;分离出装置D中三氯乙酸的方法是_______ 。
(4)装置E的溶液中除了OH-、ClO-外,还含有_______ (阴离子),检验该阴离子的方法是_______ 。
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol/L碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol/L Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_______ 。滴定反应的原理:CCl3CHO+OH-=CHCl3+HCOO-;HCOO-+I2=H++2I-+CO2↑;I2+2S2O =2I-+S4O
=2I-+S4O 。
。

查阅资料,有关信息如下。
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质如表所示:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器a的名称是
(2)装置A中发生反应的化学方程式为
(3)装置D可采用
(4)装置E的溶液中除了OH-、ClO-外,还含有
(5)测定产品纯度:称取产品0.40g配成待测溶液,加入0.1000mol/L碘标准溶液22.00mL,再加入适量Na2CO3溶液,待反应完全后,加盐酸调节溶液的pH,立即用0.02000mol/L Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


