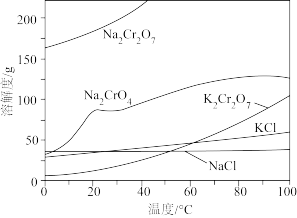
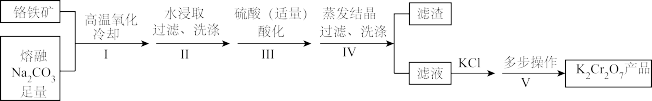解答题-原理综合题 适中0.65 引用1 组卷122
在Na2CrO4溶液中存在如下平衡:2CrO (黄色)+2H+
(黄色)+2H+ Cr2O
Cr2O (橙色)+H2O
(橙色)+H2O
(1)室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
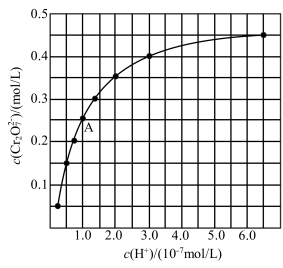
①根据A点数据计算上述平衡的平衡常数K=_____ 。
②下列说法不正确的是_____ 。
A.加水稀释,平衡右移,K值增大
B.向Na2CrO4溶液中缓慢滴加5~10滴6mol/LNaOH溶液,溶液变为黄色
C.若达到A点的时间为 ,则v(CrO
,则v(CrO )=0.1mol/(L•s)
)=0.1mol/(L•s)
D.若升高温度,溶液中CrO 的平衡转化率减小,则该反应的△H>0
的平衡转化率减小,则该反应的△H>0
(2)利用Na2CrO4固体制备K2Cr2O7晶体的具体操作步骤如图:
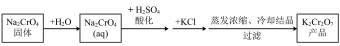
①加H2SO4酸化的目的是_____ 。
②为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
I.滴定前滴定管需要润洗,方法是:从滴定管上口加入3~5mL所要盛装的溶液,______ ,然后,一手控制活塞,将液体从滴定管下部放入预置的烧杯中。
II.下列关于滴定分析的操作,不正确的是_____ 。
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
III.某小组改用分光光度法测定产品纯度,但测得的质量分数比氧化还原反应准确测定的数值明显偏低,原因是_____ (已知:K2Cr2O7溶液的吸光度与其浓度成正比例,而且均与溶液呈现的颜色有高度关联)。
(1)室温下,初始浓度为1.0mol•L-1的Na2CrO4溶液中c(Cr2O

①根据A点数据计算上述平衡的平衡常数K=
②下列说法不正确的是
A.加水稀释,平衡右移,K值增大
B.向Na2CrO4溶液中缓慢滴加5~10滴6mol/LNaOH溶液,溶液变为黄色
C.若达到A点的时间为
D.若升高温度,溶液中CrO
(2)利用Na2CrO4固体制备K2Cr2O7晶体的具体操作步骤如图:

①加H2SO4酸化的目的是
②为了测定K2Cr2O7产品的纯度,可采用氧化还原滴定法。
I.滴定前滴定管需要润洗,方法是:从滴定管上口加入3~5mL所要盛装的溶液,
II.下列关于滴定分析的操作,不正确的是
A.用量筒量取25.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
III.某小组改用分光光度法测定产品纯度,但测得的质量分数比氧化还原反应准确测定的数值明显偏低,原因是
22-23高二上·浙江绍兴·期末
类题推荐
重铬酸钾是实验常用的基准试剂和氧化剂,其纯度是重要的品质指标。化学实验小组采用氧化还原滴定法来测定某 样品的纯度,测定方法如下:
样品的纯度,测定方法如下:
准确称取样品2.000g,配成250.00mL溶液,用移液管吸取25.00mL溶液于碘量瓶中,加入10mL2mol•L 硫酸溶液、2g(过量)KI固体,密封在暗处静置5min;另加100mL水稀释,用0.2000mol⋅L
硫酸溶液、2g(过量)KI固体,密封在暗处静置5min;另加100mL水稀释,用0.2000mol⋅L
 标准溶液滴定至溶液呈黄绿色,再加入3mL淀粉溶液,继续滴定至终点。平行滴定三次,消耗
标准溶液滴定至溶液呈黄绿色,再加入3mL淀粉溶液,继续滴定至终点。平行滴定三次,消耗 标准溶液的体积分别为19.22mL、20.32mL和20.34mL。
标准溶液的体积分别为19.22mL、20.32mL和20.34mL。
滴定过程中涉及的反应有: (未配平)、
(未配平)、 。
。
(1)滴定前滴定管需要润洗,方法是:从滴定管上口加入3~5mL所要盛装的溶液,___________ (请补全操作);再将液体从滴定管下部放入预置的烧杯中。
(2) 溶液呈碱性。将
溶液呈碱性。将 标准溶液装入碱式滴定管后,排气泡的正确操作为___________(填字母)。
标准溶液装入碱式滴定管后,排气泡的正确操作为___________(填字母)。
(3)下列关于滴定分析的操作,不正确的有___________ (填字母)。
A.若无移液管,可用25mL量筒量取待测液于碘量瓶中
B.滴定时通常在锥形瓶下垫一张白纸
C.滴定时要适当控制滴定速度
D.滴定时应一直观察滴定管中溶液体积的变化
E.读数时应将滴定管从架上取下,捏住滴定管上端无刻度处,使滴定管保持垂直
F.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(4)在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,___________ (请补全操作),继续摇动锥形瓶,观察颜色变化。
(5)判断到达滴定终点的实验现象是___________ 。
(6)计算该 样品的纯度(写出计算过程)
样品的纯度(写出计算过程)___________ 。
准确称取样品2.000g,配成250.00mL溶液,用移液管吸取25.00mL溶液于碘量瓶中,加入10mL2mol•L
滴定过程中涉及的反应有:
(1)滴定前滴定管需要润洗,方法是:从滴定管上口加入3~5mL所要盛装的溶液,
(2)
A.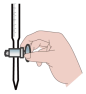 | B. | C. | D. |
A.若无移液管,可用25mL量筒量取待测液于碘量瓶中
B.滴定时通常在锥形瓶下垫一张白纸
C.滴定时要适当控制滴定速度
D.滴定时应一直观察滴定管中溶液体积的变化
E.读数时应将滴定管从架上取下,捏住滴定管上端无刻度处,使滴定管保持垂直
F.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
(4)在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,
(5)判断到达滴定终点的实验现象是
(6)计算该
为测定产品中Na2Cr2O7•2H2O(M=298g•mol-1)的纯度,利用滴定原理测定Cr2O 含量的方法如下:
含量的方法如下:
步骤Ⅰ:称取1.0g产品配成100mL溶液,取出10.00 mL溶液于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.100 mol·L-1 Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
(1)步骤Ⅲ中滴加的指示剂为_______ ;滴定达到终点时的实验现象是____________ 。
(2)步骤Ⅲ中a的读数如图所示,则:

①a=___________ 。
②产品的纯度为___________ %(保留3位有效数字)。
(3)①下列关于滴定分析的操作,不正确的是___________ 。
A.用量筒量取10.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,___________ 继续摇动锥形瓶,观察颜色变化。(请在横线上补全操作)
(4)以下操作会造成产品纯度测定值偏高的是___________(填字母)。
步骤Ⅰ:称取1.0g产品配成100mL溶液,取出10.00 mL溶液于锥形瓶中,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液充分反应:Cr2O
步骤Ⅲ:向锥形瓶中滴入几滴指示剂。用滴定管量取0.100 mol·L-1 Na2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(2)步骤Ⅲ中a的读数如图所示,则:

①a=
②产品的纯度为
(3)①下列关于滴定分析的操作,不正确的是
A.用量筒量取10.00mL待测液转移至锥形瓶
B.滴定时要适当控制滴定速度
C.滴定时应一直观察滴定管中溶液体积的变化
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.平行滴定时,须重新装液并调节液面至“0”刻度或“0”刻度以下
②在接近终点时,使用“半滴操作”可提高测量的准确度。其方法是:将旋塞稍稍转动,使半滴溶液悬于管口,用锥形瓶内壁将半滴溶液沾落,
(4)以下操作会造成产品纯度测定值偏高的是___________(填字母)。
| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网