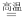解答题-工业流程题 适中0.65 引用2 组卷499
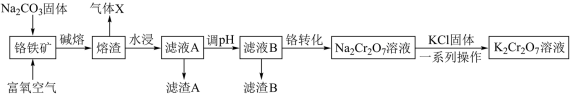
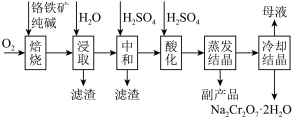
工业上以铬矿渣(主要成分为 ,含有少量的
,含有少量的 )制备重要化工原料重铬酸钾
)制备重要化工原料重铬酸钾 晶体的工艺流程如下:
晶体的工艺流程如下:
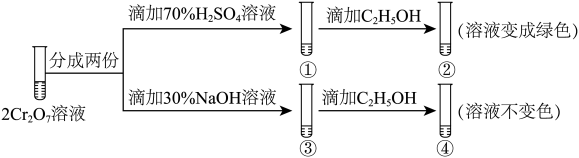
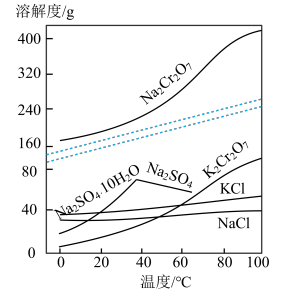
已知:①焙烧可将 的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
的氧化物转化为可溶性钠盐;②几种物质在水中的溶解度随温度变化的曲线如图。
回答下列问题:
(1)“氧化焙烧”时, 被氧化生成
被氧化生成 的化学方程式为
的化学方程式为_______ 。
(2)“滤渣I”、“滤渣II”的主要成分分别是_______ 、_______ (填化学式):实验室中进行“除杂”操作用到的玻璃仪器有_______ 。
(3)分离提纯后得到固体的化学式为_______ ;“一系列操作”是_______ 、过滤、洗涤、干燥,最后得到 晶体。
晶体。
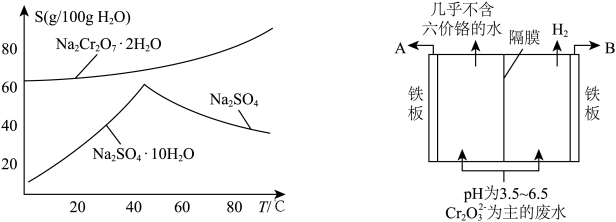
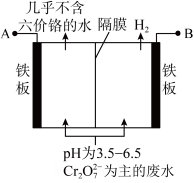
(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到 (标准状况下)时有
(标准状况下)时有_______ molCr2O 被还原,一段时间后产生
被还原,一段时间后产生 和
和 沉淀,若电解后溶液中
沉淀,若电解后溶液中 ,则
,则
_______  。(已知
。(已知 )
)


已知:①焙烧可将

回答下列问题:
(1)“氧化焙烧”时,
(2)“滤渣I”、“滤渣II”的主要成分分别是
(3)分离提纯后得到固体的化学式为
(4)生产过程中产生的含铬废水通常采用电解法处理,耐酸电解槽用铁板作阴阳极,槽中盛放含铬废水,原理如图所示。若不考虑气体的溶解,当收集到

22-23高三上·山东烟台·期末
类题推荐
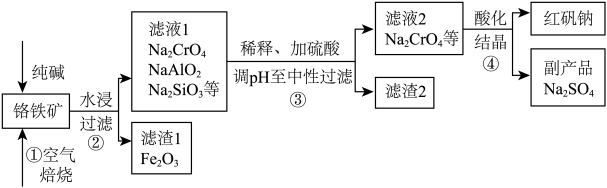
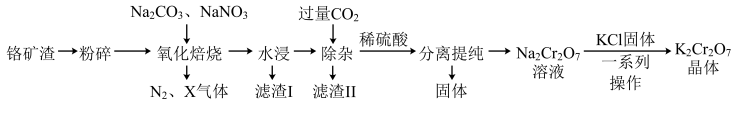
铬的化合物应用广泛,工业上以铬铁矿(含 、
、 氧化物等杂质)为主要原料制备红矾钠
氧化物等杂质)为主要原料制备红矾钠 的工艺流程如下图。已知:①
的工艺流程如下图。已知:① 中
中 化合价为+3;②焙烧的目的是将
化合价为+3;②焙烧的目的是将 转化为
转化为 ,并将
,并将 、
、 氧化物转化为可溶性钠盐。
氧化物转化为可溶性钠盐。
请回答下列问题:
(1)基态铬原子的价电子排布式为_____ 。
(2)为了提高焙烧效果,可采取的一种措施是_____
(3)浸取所得的滤渣为 ,由此推断
,由此推断 焙烧时发生反应的主要化学方程式为:
焙烧时发生反应的主要化学方程式为:_____ 。
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数 与
与 的关系如图所示。当溶液中可溶性组分浓度
的关系如图所示。当溶液中可溶性组分浓度 时,可认为已除尽。则“中和”时
时,可认为已除尽。则“中和”时 的理论范围为
的理论范围为_____ ;“酸化”过程中的离子方程式为_____ 。

(5)工业上常用电解法处理含 的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生
的酸性废水,用金属铁阳极、石墨作阴极,一段时间后产生 和
和 沉淀。若电解后溶液中
沉淀。若电解后溶液中 ,则
,则
_____  。(已知
。(已知 ,
, 可从第(4)小题图中计算得出)。
可从第(4)小题图中计算得出)。
(6)电解法处理含 的酸性废水,下列有关原理的说法中正确的是(填序号):_____。
的酸性废水,下列有关原理的说法中正确的是(填序号):_____。

请回答下列问题:
(1)基态铬原子的价电子排布式为
(2)为了提高焙烧效果,可采取的一种措施是
(3)浸取所得的滤渣为
(4)常温下,矿物中相关元素可溶性组分物质的量浓度的常用对数

(5)工业上常用电解法处理含
(6)电解法处理含
| A.阳极反应为: |
| B.电解过程中溶液 |
| C.如果石墨作阳极,电解过程不变 |
| D.电路中每转移 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网