解答题-原理综合题 适中0.65 引用1 组卷59
“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应I:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应II:2HI(g) H2(g) + I2(g)
H2(g) + I2(g)
反应III:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
2H2O(g) + 2SO2(g) + O2(g)
(1)反应III实际上分两步进行:
H2SO4(g)=SO3(g) + H2O(g) ∆H1
2SO3(g) 2SO2(g) + O2(g) ∆H2
2SO2(g) + O2(g) ∆H2
则反应III的反应热∆H=_______ (用∆H1、∆H2表示)。
(2)某温度下将1mol HI充入密闭容器中发生反应II,达到第1次平衡后,用选择性膜完全分离出H2,达到第2次平衡后再次分离H2,重复多次,平衡时n(HI)如下表:
①第1次平衡时,HI的转化率为_______ %。
②归纳出分离H2的次数对HI转化率的影响:_______ 。
③计算第2次平衡时H2和I2的物质的量______ (写出计算过程)。
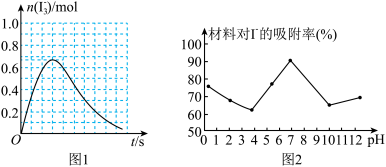
(3)反应I发生时,溶液中存在化学平衡:I2(aq) + I-(aq)
 (aq),其反应速率极快且平衡常数很大。现将1mol SO2缓缓通入含1 mol I2的水溶液中恰好完全反应。在答题卡中,画出溶液中I
(aq),其反应速率极快且平衡常数很大。现将1mol SO2缓缓通入含1 mol I2的水溶液中恰好完全反应。在答题卡中,画出溶液中I 的物质的量n( I
的物质的量n( I )随反应时间t变化的曲线图
)随反应时间t变化的曲线图______ 。
反应I:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应II:2HI(g)
反应III:2H2SO4(g)
(1)反应III实际上分两步进行:
H2SO4(g)=SO3(g) + H2O(g) ∆H1
2SO3(g)
则反应III的反应热∆H=
(2)某温度下将1mol HI充入密闭容器中发生反应II,达到第1次平衡后,用选择性膜完全分离出H2,达到第2次平衡后再次分离H2,重复多次,平衡时n(HI)如下表:
| 达到平衡的次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
①第1次平衡时,HI的转化率为
②归纳出分离H2的次数对HI转化率的影响:
③计算第2次平衡时H2和I2的物质的量
(3)反应I发生时,溶液中存在化学平衡:I2(aq) + I-(aq)
22-23高二上·广东江门·期中
类题推荐
研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
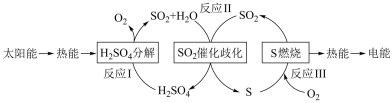
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为________ 。
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
归纳出分离 H2的次数对 HI 转化率的影响________ 。第 2 次平衡时 I2的物质的量为 n(I2)=_____ mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌ (aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2缓缓通入含 1 mol I2的水溶液中恰好完全反应。请在下图中画出溶液中 的物质的量 n( I3- )随反应时间 t 变化的曲线图
的物质的量 n( I3- )随反应时间 t 变化的曲线图____ 。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:

①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ•mol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJ•mol -1
反应Ⅱ的热化学方程式为
②对于反应Ⅱ,将投料比【n(SO2):n(H2O)】为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是

A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4在平衡体系中物质的量分数
C.其他条件相同时,投料比【n(SO2):n(H2O)】改变为 2:1,可提高 SO2的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) ⇌ H2(g) + I2(g)
反应C:2H2SO4(g) ⇌ 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
| 达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
| n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2的次数对 HI 转化率的影响
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I‑(aq)⇌

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网