解答题-原理综合题 适中0.65 引用3 组卷137
诺贝尔化学奖获得者GeorgeA.Olah提出了“甲醇经济”的概念,他建议用甲醇来代替目前广泛使用的化石燃料。工业上用天然气为原料,分为两个阶段制备甲醇:
(i)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
(ii)合成甲醇:CO(g)+2H2(g) CH3OH(g) ΔH=-90.67 kJ·mol-1
CH3OH(g) ΔH=-90.67 kJ·mol-1
回答下列问题:
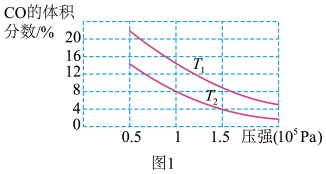
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1_______ T2(填“<”或“=”),理由是_______ 。
(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g) CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为
CO(g)+H2O(g) ΔH=+41.17 kJ·mol-1,为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳的体积比为_______ 。
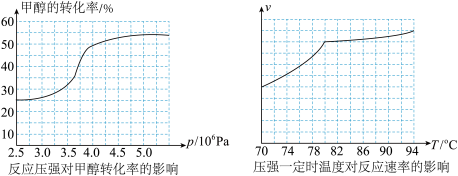
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g) CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
CH3OH(g) ΔH。实验测得平衡时H2的转化率随温度、压强的变化如图2所示。
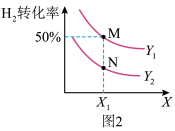
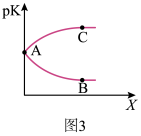
①图2中X代表_______ (填“温度”或“压强”)。图3中正确表示该反应的平衡常数的负对数pK(pK=-lgK)与X的关系的曲线_______ (填“AC”或“AB”)。
②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为_______ 。
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为_______ 。
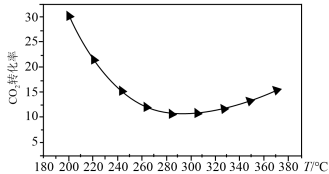
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。
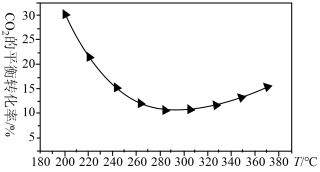
CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因_______ 。
(i)制备合成气:CH4(g)+H2O(g)
(ii)合成甲醇:CO(g)+2H2(g)
回答下列问题:
(1)制备合成气反应中,平衡混合物中CO的体积分数与压强的关系如图1所示,判断T1和T2的大小关系:T1

(2)工业生产中为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应CO2(g)+H2(g)
(3)在体积不变的密闭容器中投入0.5 mol CO和1 mol H2,不同条件下发生反应:CO(g)+2H2(g)

①图2中X代表

②若图2中M点对应的容器体积为5 L,此时容器的压强为b kPa,则N点的压强平衡常数Kp为
(4)为节约化石能源,用CO2代替CO作为制备甲醇的碳源正成为当前研究的焦点。
①二氧化碳加氢合成甲醇和水蒸气的热化学方程式为
②研究表明在二氧化碳合成甲醇的原料气中加入CO可以降低CO2与H2反应的活化能。在200~360℃、9MPa时,合成气初始组成H2、CO、CO2物质的量之比为7:2:1的条件下研究甲醇的合成反应(如图所示)。

CO2的平衡转化率随温度的升高先减小后增大,请分析可能的原因
23-24高三上·湖北恩施·阶段练习
类题推荐
甲醇是一种可再生能源,具有开发和应用的广阔前景,其合成反应为CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g) CH3OH(g) △H=
CH3OH(g) △H=________ 。
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为___ 。
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通入密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:

(3)比较T1、T2、T3的大小,并说明理由____ 。
(4)平衡常数K(b)___ K(d)、正反应速率v(a)___ v(b)(均填“大于”“小于”或“等于”)。
(5)c点时反应的压强平衡常数Kp=___ (kPa)-2(用数字表达式表示,Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是______ 。
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时 减小
减小 E. CH3OH的体积分数增加
E. CH3OH的体积分数增加
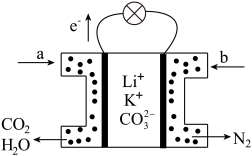
(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为________ 。
 CH3OH(g)。
CH3OH(g)。(1)下表列出了一些化学键断裂需要的能量数据,则CO(g)+2H2(g)
 CH3OH(g) △H=
CH3OH(g) △H=| 化学键 | H-H | C-O | C O O | H-O | C-H |
| E(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
工业上用天然气为原料合成甲醇,分为两阶段。
I制备合成气:CH4+H2O(g)=CO+3H2。
(2)为解决合成气中H2过量CO不足问题,原料气中添加CO2,发生反应CO2+H2=CO+H2O。为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为
Ⅱ合成甲醇
实验室进行模拟合成实验。将1 molCO和2molH2通入密闭容器中,测得CO在不同温度下的平衡转化率与压强的关系如图所示:

(3)比较T1、T2、T3的大小,并说明理由
(4)平衡常数K(b)
(5)c点时反应的压强平衡常数Kp=
(6)a点时,保持温度不变,将密闭容器的容积压缩刮原来的,对平衡体系产生的影响是
A. c(H2)减少 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡时
 减小
减小 E. CH3OH的体积分数增加
E. CH3OH的体积分数增加(7)科研人员设计了一种新型甲醇燃料电池,其电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-,该电池工作时的负极电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网