解答题-原理综合题 适中0.65 引用1 组卷160
CO2的回收及综合利用越来越受到国际社会的重视,将CO2转化为高附加值化学品已成为有吸引力的解决方案。
I.例如可以用CO2、H2为原料合成CH3OH反应:CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH。CO2和H2在某催化剂表面上合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。
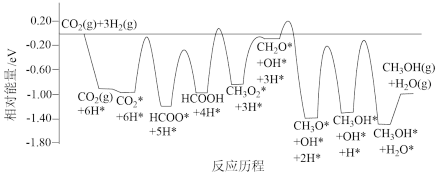
(1)反应的ΔH_______ 0(填“>”或“<”):该历程中最小能垒(活化能)步骤的化学方程式为_______ 。
II.已知研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应I:CH4(g) + CO2(g) 2CO(g) + 2H2(g) ΔH=+234.0 kJ/mol
2CO(g) + 2H2(g) ΔH=+234.0 kJ/mol
在反应过程中还发生反应II:H2(g) + CO2(g) H2O(g)+CO(g) ΔH2
H2O(g)+CO(g) ΔH2
(2)已知部分化学键的键能数据如下表所示:
则ΔH2=_______ kJ/mol。
(3)在密闭容器中充入CO2与CH4,下列能够判断反应I达到平衡状态的是_______ 。
A.容积固定的绝热容器中,温度保持不变
B.一定温度和容积固定的容器中,混合气体的密度保持不变
C.一定温度和容积固定的容器中,混合气体的平均相对分子质量保持不变
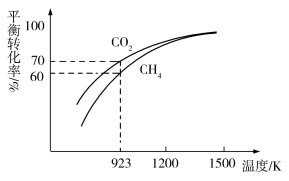
(4)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
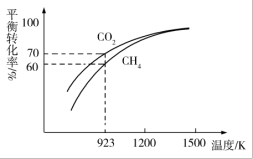
①923K时CO2的平衡转化率大于CH4的原因是_______ 。
②计算923K时反应II的化学平衡常数K=_______ (计算结果保留小数点后两位)。
(5)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~400℃,乙酸的生成速率先减小后增大的原因______ 。
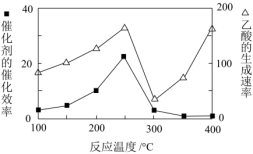
②为了提高该反应中CH4的转化率,可以采取的措施是_______ (只答一条即可)。
I.例如可以用CO2、H2为原料合成CH3OH反应:CO2(g) + 3H2(g)=CH3OH(g) + H2O(g) ΔH。CO2和H2在某催化剂表面上合成甲醇的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。

(1)反应的ΔH
II.已知研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。
工业上CO2与CH4发生反应I:CH4(g) + CO2(g)
在反应过程中还发生反应II:H2(g) + CO2(g)
(2)已知部分化学键的键能数据如下表所示:
| 化学键 | H-O | H-H | C=O | C≡O |
| 键能(kJ/mol) | 413 | 436 | 803 | 1076 |
则ΔH2=
(3)在密闭容器中充入CO2与CH4,下列能够判断反应I达到平衡状态的是
A.容积固定的绝热容器中,温度保持不变
B.一定温度和容积固定的容器中,混合气体的密度保持不变
C.一定温度和容积固定的容器中,混合气体的平均相对分子质量保持不变
(4)工业上将CH4与CO2按物质的量1:1投料制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923K时CO2的平衡转化率大于CH4的原因是
②计算923K时反应II的化学平衡常数K=
(5)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~400℃,乙酸的生成速率先减小后增大的原因

②为了提高该反应中CH4的转化率,可以采取的措施是
22-23高二上·福建泉州·期末
类题推荐
研究CO2与CH4反应使之转化为CO和H2,对减缓燃料危机和减弱温室效应具有重要的意义。工业上CO2与CH4发生反应Ⅰ:CH4(g)+CO2(g)=2CO(g)+2H2(g) ∆H1.在反应过程中还发生反应Ⅱ:H2(g)+CO2(g)=H2O(g)+CO(g) ∆H2=+41 kJ·mol−1。
(1)已知部分化学键的键能数据如下表所示:
则∆H1=_______ kJ·mol−1,反应I在一定条件下能够自发进行的原因是_______ ,在密闭容器中加入CO2与CH4发生反应,下列能够判断反应反应I达到平衡状态的是_______ (填标号)。
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
D.一定温度和容积固定的容器中,H2和H2O物质的量之和保持不变
(2)将1mol CH4与1mol CO2在2L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。
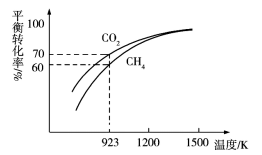
①923 K时CO2的平衡转化率大于CH4的原因是_______ 。
②计算923 K时反应Ⅰ的化学平衡常数K=_______ (计算结果保留小数点后两位)。
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是_______ 。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。
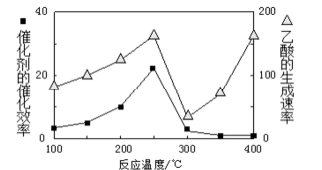
250~300℃时,温度升高而乙酸的生成速率降低的原因是_______ 。
(1)已知部分化学键的键能数据如下表所示:
| 化学键 | C-H | H-H | C=O | C≡O(CO) |
| 键能(kJ·mol-1) | 413 | 436 | 803 | 1076 |
A.一定温度下,容积固定的容器中,密度保持不变
B.容积固定的绝热容器中,温度保持不变
C.一定温度和容积固定的容器中,平均相对分子质量不变
D.一定温度和容积固定的容器中,H2和H2O物质的量之和保持不变
(2)将1mol CH4与1mol CO2在2L密闭容器中反应制取CO和H2时,CH4和CO2的平衡转化率随温度变化关系如图所示。

①923 K时CO2的平衡转化率大于CH4的原因是
②计算923 K时反应Ⅰ的化学平衡常数K=
③1200 K以上CO2和CH4的平衡转化率趋于相等的原因可能是
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。

250~300℃时,温度升高而乙酸的生成速率降低的原因是
已知研究 与
与 反应使之转化为
反应使之转化为 和
和 ,对减缓燃料危机和减弱温室效应具有重要的意义。工业上
,对减缓燃料危机和减弱温室效应具有重要的意义。工业上 与
与 发生反应
发生反应 ,在反应过程中还发生反应
,在反应过程中还发生反应
(1)已知部分化学键的键能数据如下表所示:
则
___________  ,反应
,反应 在一定条件下能够自发进行的原因是
在一定条件下能够自发进行的原因是___________ 。
(2)在密闭容器中充入 与
与 ,下列能够判断反应
,下列能够判断反应 达到平衡状态的是___________。
达到平衡状态的是___________。
(3)工业上将 与
与 按物质的量1:1投料制取
按物质的量1:1投料制取 和
和 时,
时, 和
和 的平衡转化率随温度变化关系如图所示。
的平衡转化率随温度变化关系如图所示。
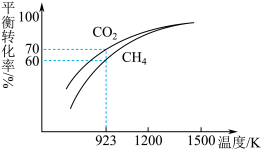
①923K时 的平衡转化率大于
的平衡转化率大于 的原因是
的原因是___________ 。
②计算 时反应Ⅱ的化学平衡常数
时反应Ⅱ的化学平衡常数
_________ (计算结果保留小数点后两位)
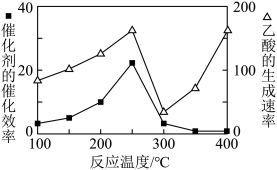
(4)以二氧化钛表面覆盖 为催化剂,可以将
为催化剂,可以将 和
和 直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~400℃,乙酸的生成速率先减小后增大的原因
直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~400℃,乙酸的生成速率先减小后增大的原因___________ 。
(1)已知部分化学键的键能数据如下表所示:
| 化学键 | ||||
| 键能 | 413 | 436 | 803 | 1076 |
(2)在密闭容器中充入
| A.容积固定的恒温容器中,温度保持不变 |
| B.一定温度和容积固定的容器中,混合气体的密度保持不变 |
| C.一定温度和容积固定的容器中,压强不在变化 |
| D.一定温度和容积固定的容器中, |

①923K时
②计算
(4)以二氧化钛表面覆盖

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网