解答题-实验探究题 较难0.4 引用4 组卷771
某化学小组探究铜和稀硝酸的反应:
资料1 铜与浓度低于 反应很慢,且放热极少。
反应很慢,且放热极少。
(1)实验预测
①铜与稀 反应的离子方程式为
反应的离子方程式为_______ 。
②小组同学预测铜与稀 的反应速率应逐渐减慢,其理论依据是
的反应速率应逐渐减慢,其理论依据是_______ 。
(2)实验实施
实验I:铜丝与 反应。
反应。
实验II:探究Cu与稀 在无氧环境下反应所得溶液显绿色的原因:
在无氧环境下反应所得溶液显绿色的原因:
资料2:
i.上述溶液中均不存在-3价的氮; 为淡黄色沉淀。
为淡黄色沉淀。
ii. 是一种弱酸,
是一种弱酸, ;
;
①通过上述实验,证明铜与稀 反应过程中可能有
反应过程中可能有 生成,理由是
生成,理由是_______ 。
②分析阶段B溶液呈绿色的原因_______ 。
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因_______ 。
④写出铜和稀 反应的生成
反应的生成 的化学方程式
的化学方程式_______ 。
(3)继续探究:
探究铜和稀 反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
反应速率变化的原因:小组同学依据实验I的数据,画出铜和稀硝酸反应的速率时间图像为下图:
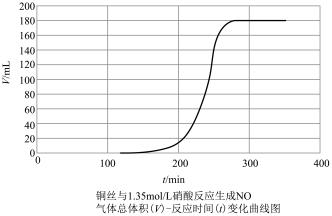
甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物 有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为
有催化作用,并通过实验证明了自己的猜想:甲同学设计的实验方案为_______ 。
(4)反思总结:通过上述实验探究过程,铜和 的反应实际过程可能为
的反应实际过程可能为_______ 。
资料1 铜与浓度低于
(1)实验预测
①铜与稀
②小组同学预测铜与稀
(2)实验实施
实验I:铜丝与
| 实验装置 | 实验操作 | 实验现象 |
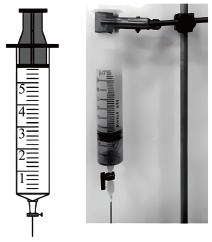 | 在洁净的注射器中装入已活化铜丝2.3g,再用注射器抽取 | 反应较慢阶段A:反应前90min几乎没有现象,90min左右才有很少气泡产生(该气体遇空气变成红棕色),溶液为浅蓝色;反应较快阶段B:之后溶液逐渐变为绿色;最后阶段C:在反应结束前15min左右时,体系溶液为深蓝色。 |
操作及现象 实验序号 | 取不同阶段的溶液进行实验操作 | 实验现象 | ||
| 阶段A溶液 | 阶段B溶液 | 阶段C溶液 | ||
| 1 | 滴加 | 褪色,滴6滴后溶液不褪色 | 褪色,但滴20滴后溶液仍然褪色 | 褪色,滴10滴后溶液不再褪色 |
| 2 | 滴加3% | 无明显现象 | 少量淡黄色沉淀 | 较多黄色沉淀 |
| 3 | 滴加稀 | 无明显现象 | 变蓝色 | 无明显现象 |
i.上述溶液中均不存在-3价的氮;
ii.
①通过上述实验,证明铜与稀
②分析阶段B溶液呈绿色的原因
③从平衡角度分析实验II中,阶段B溶液中滴加稀硫酸溶液由绿色变蓝的原因
④写出铜和稀
(3)继续探究:
探究铜和稀

甲同学提出,铜与稀硝酸反应,反应开始较慢(阶段A),后较快(阶段B),可能是因为反应生成的产物
(4)反思总结:通过上述实验探究过程,铜和
2023·北京顺义·一模
类题推荐
某化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀 的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是
的试管中,开始无明显现象,后逐渐有小气泡生成,该气体是_______ 。在液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓 反应,装置、现象如下:
反应,装置、现象如下:
①A中铜与浓 产生红棕色气体的化学方程式是
产生红棕色气体的化学方程式是_______ 。
②实验现象“最初反应较慢,随后加快”的原因可能是_______ 。
(3)除上述可能原因外,有文献记载:铜与浓 反应一旦发生就变快,是因为开始生成的
反应一旦发生就变快,是因为开始生成的 溶于水形成
溶于水形成 (弱酸,不稳定,水溶液为淡蓝色),它再和Cu反应,反应就加快。实验探究如下:
(弱酸,不稳定,水溶液为淡蓝色),它再和Cu反应,反应就加快。实验探究如下:
Ⅰ.向1 mL浓硝酸中加入几滴30% 溶液、铜片,反应较慢,溶液呈蓝色。
溶液、铜片,反应较慢,溶液呈蓝色。
已知:浓硝酸与 溶液不反应。
溶液不反应。
①Ⅰ实验中反应变慢的原因是_______ 。
② 与水反应的离子方程式是
与水反应的离子方程式是_______ 。
③对 、
、 分别与Cu反应快慢进行实验探究。
分别与Cu反应快慢进行实验探究。
a.III中“放置一段时间”的目的是_______ 。
b.实验Ⅱ、Ⅲ得出的实验结论是_______ 。
A. 与Cu反应快 B.
与Cu反应快 B. 与Cu反应快
与Cu反应快
(4)化学小组同学结合实验甲、乙中 被还原后的气体产物以及实验Ⅱ的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是
被还原后的气体产物以及实验Ⅱ的产物,综合上述实验,分析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是_______ 。
(1)实验甲:将铜片放入盛有稀
(2)实验乙:铜与浓
| 实验装置 | 实验现象 |
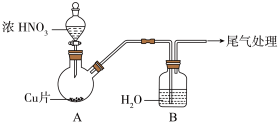 | A中:最初反应较慢,随后加快,反应剧烈,产生红棕色气体,溶液呈绿色;B中:溶液呈淡蓝色。 |
②实验现象“最初反应较慢,随后加快”的原因可能是
(3)除上述可能原因外,有文献记载:铜与浓
Ⅰ.向1 mL浓硝酸中加入几滴30%
已知:浓硝酸与
①Ⅰ实验中反应变慢的原因是
②
③对
| 序号 | 实验操作 | 实验现象 |
| Ⅱ | 取实验乙装置B中溶液,加入一定量 | 立即产生无色气体;液体上方红棕色 |
| Ⅲ | 取B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较II慢;液面上方呈浅红棕色 |
b.实验Ⅱ、Ⅲ得出的实验结论是
A.
(4)化学小组同学结合实验甲、乙中
某学习小组探究铜与稀硝酸反应速率变化时,将3.2g铜丝装入注射器(无氧环境)中,再抽取25mL1.35mol·L-1稀硝酸。实验现象:反应开始阶段无明显现象,90min左右才有很少气泡产生,150min左右体系溶液为浅蓝色(反应较慢阶段A),之后逐渐变为绿色(反应较快阶段B),最终溶液呈深蓝色(阶段C)。
(1)铜与稀硝酸反应的离子方程式为____ 。
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明____ 。
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
查阅资料表明,硝酸在反应过程中首先生成HNO2,已知HNO2是弱酸(电离方程式HNO2 H++NO
H++NO ),遇微热即分解成NO和NO2,NO
),遇微热即分解成NO和NO2,NO 可与Cu2+生成绿色络合离子Cu(NO2)
可与Cu2+生成绿色络合离子Cu(NO2) 。
。
①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,____ ,且c(Cu2+)增大,与NO 结合生成Cu(NO2)
结合生成Cu(NO2) ,溶液呈绿色;(用平衡移动原理解释)
,溶液呈绿色;(用平衡移动原理解释)
③最后由于____ ,c(NO )减小,c[Cu(NO2)
)减小,c[Cu(NO2) ]减小,而c(Cu2+)较大,溶液呈深蓝色。
]减小,而c(Cu2+)较大,溶液呈深蓝色。
(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO 是催化剂,请设计实验验证推测:
是催化剂,请设计实验验证推测:____ 。(可供选择的试剂:铜丝、2mol·L-1硝酸、1.35mol·L-1硝酸、NaNO2固体)
(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和____ 。
(1)铜与稀硝酸反应的离子方程式为
(2)室温26.6℃,反应过程中最高温度27.8℃;在45℃水浴中重复实验,反应现象变化不大,说明
(3)为探究铜与1.35mol·L-1稀硝酸在无氧条件下显绿色的原因,分别取A、B、C阶段溶液进行实验。实验操作和现象如表:
| 序号 | 实验内容 | A溶液(浅蓝色) | B溶液(绿色) | C溶液(深蓝色) |
| 1 | 滴加0.001mol·L-1KMnO4溶液 | 褪色,滴入5~6滴后不再褪色 | 褪色,但滴入20滴后仍褪色 | 褪色,滴入10滴后不再褪色 |
| 2 | 加热较长时间后再滴加0.001mol·L-1KMnO4溶液 | 不褪色 | 不褪色 | 不褪色 |
| 3 | 逐滴滴加稀硫酸 | 无明显现象 | 变蓝色 | 无明显现象 |
| 4 | 逐滴滴加NaOH溶液 | 变浅绿色 | 无明显现象 | 变浅绿色 |
①分析可知溶液中颜色浅蓝→绿→深蓝的原因:反应开始时溶液中c(H+)较大,c(Cu2+)较小,溶液呈浅蓝色;
②反应进行过程中,
③最后由于
(4)在反应体系温度几乎不变的情况下,反应速率先慢后快,推测反应过程中有催化剂生成,并推测HNO2或NO
(5)可推测反应分为三步进行:Cu+3HNO3=Cu(NO3)2+HNO2+H2O、2HNO2=NO+NO2+H2O和
某化学兴趣学习小组用实验探究铜与硝酸反应的快慢及产物。
(1)[实验1]将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,溶液呈蓝色,在液面上方出现浅红棕色气体的化学方程式为___________ 。
(2)[实验2]铜与浓HNO3反应,装置、现象如下:
实验现象“最初反应较慢,随后加快”的原因可能是___________ 。
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。设计[实验3]探究如下:
[实验3-1]向1mL浓硝酸中加入几滴30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
[实验3-2]向1mL浓硝酸中加入几滴30%H2O2溶液,无明显变化。
①[实验2]的B溶液中存在的阴离子有NO 、
、___________ 和极少量的OH-。[实验3-1]中反应变慢的原因是___________ 。
②对比[实验3-1]与[实验3-2]的现象分析,浓硝酸的氧化性比亚硝酸氧化性___________ (填“强”或“弱”)。
③对生成HNO2后反应变快的原因进行实验探究。
[实验3-3]中加入的固体为___________ 。[实验3-4]中“放置一段时间”的目的是___________ 。
(4)化学小组同学结合[实验1]、[实验2]中HNO3被还原后的气体产物以及[实验3-3]的产物,综合上述实验,分析判断[实验1]中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是___________ 。
(1)[实验1]将铜片放入盛有稀HNO3的试管中,开始无明显现象,后逐渐有小气泡生成,溶液呈蓝色,在液面上方出现浅红棕色气体的化学方程式为
(2)[实验2]铜与浓HNO3反应,装置、现象如下:
| 实验装置 | 实验现象 |
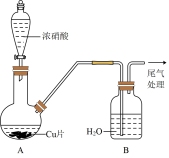 | A中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿色 B中:溶液呈淡蓝色 |
(3)有文献记载:铜与浓HNO3反应一旦发生就变快,是因为开始生成的NO2溶于水形成HNO2(弱酸,不稳定),它再和Cu反应,反应就加快。设计[实验3]探究如下:
[实验3-1]向1mL浓硝酸中加入几滴30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
[实验3-2]向1mL浓硝酸中加入几滴30%H2O2溶液,无明显变化。
①[实验2]的B溶液中存在的阴离子有NO
②对比[实验3-1]与[实验3-2]的现象分析,浓硝酸的氧化性比亚硝酸氧化性
③对生成HNO2后反应变快的原因进行实验探究。
| 序号 | 实验操作 | 实验现象 |
| [实验3-3] | 取[实验2]B中溶液,加入一定量固体,再加入铜片 | 立即产生无色气体;液面上方呈红棕色 |
| [实验3-4] | 取[实验2]B中溶液,放置一段时间,溶液变为无色后,再加入铜片 | 产生无色气体,较[实验3-3]慢;液面上方呈浅红棕色 |
(4)化学小组同学结合[实验1]、[实验2]中HNO3被还原后的气体产物以及[实验3-3]的产物,综合上述实验,分析判断[实验1]中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


