解答题-实验探究题 困难0.15 引用1 组卷585
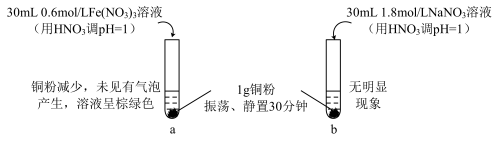
某实验小组探究 与
与 溶液的反应。取
溶液的反应。取 铜粉加入
铜粉加入 溶液(用
溶液(用 调
调 )中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
)中,振荡、静置30分钟,铜粉减少,溶液呈棕绿色,未见有气泡产生。
已知: 是难溶于水的白色固体
是难溶于水的白色固体
(1)预测铜粉可能发生的反应
反应I
反应II__________________________ 
(2)探究反应I是否发生
①取 铜粉加入
铜粉加入
_____________ 溶液中,振荡、静置30分钟,无明显现象。(所用试剂:硝酸钠和硝酸溶液)
②用传感器检测 与
与 溶液反应过程中
溶液反应过程中 浓度的变化,发现
浓度的变化,发现 浓度逐渐减少。有同学认为:
浓度逐渐减少。有同学认为: 催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
催化了铜和稀硝酸的反应,可能的催化过程如下,写出ⅰ的离子方程式。
ⅰ._____________
ⅱ.反应II
总反应:
(3)探究反应II是否发生
取 铜粉加入
铜粉加入_____________ 中,溶液迅速变为蓝绿色。取上层清液,滴加 溶液,出现白色浑浊且溶液变红,振荡后红色褪去,
溶液,出现白色浑浊且溶液变红,振荡后红色褪去, 溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因
溶液过量后浊液呈深红色。结合离子方程式解释溶液开始呈现白色浑浊最终浊液呈深红色的原因_____________ 。
(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为 与
与 或
或 形成配合物,设计实验证明棕绿色是
形成配合物,设计实验证明棕绿色是 的颜色,实验操作是
的颜色,实验操作是_____________ 。
(5)从化学反应速率和限度角度简述对 与
与 溶液反应的认识
溶液反应的认识_____________ 。
已知:
(1)预测铜粉可能发生的反应
反应I
反应II
(2)探究反应I是否发生
①取
②用传感器检测
ⅰ.
ⅱ.反应II
总反应:
(3)探究反应II是否发生
取
(4)分析“溶液呈棕绿色,未见有气泡产生”的原因
小组讨论认为,棕绿色可能是因为
(5)从化学反应速率和限度角度简述对
22-23高三上·北京石景山·期末
类题推荐
实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
资料:i.
ii.
iii.
实验 | 序号 | 试剂 | 现象 |
| I | a:10滴 b:20滴 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴 b:2滴 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴 b:20滴 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
①对于
②实验Ⅱ所得溶液中
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
②实验VI:向实验IV的试管中继续滴加足量
对比实验V、VI,结合方程式分析实验VI滴加
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
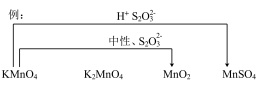
为探究  与
与  的反应,某小组同学选用三种不同的铁盐溶液(
的反应,某小组同学选用三种不同的铁盐溶液( 均约为1)进行了如下实验。
均约为1)进行了如下实验。
【查阅资料】
ⅰ.氯化亚铜 是难溶于水的白色固体。
是难溶于水的白色固体。
ⅱ. 与
与 可发生反应,生成棕色的
可发生反应,生成棕色的  。
。
【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是___________ 。
(2)为探究实验Ⅱ中白色固体的组成,小组同学设计并完成了以下实验。
步骤1:取少量洗涤后的白色固体于试管中,向其中滴加稀硝酸,观察到固体溶解,溶液变为蓝色,液面上方有少量红棕色气体生成。
步骤2:向步骤1所得溶液中滴加 溶液,生成白色沉淀。
溶液,生成白色沉淀。
①能证明实验Ⅱ白色固体中含有+1价铜的现象是___________
②步骤2中滴加 溶液的目的是
溶液的目的是___________ 。
通过以上实验,证明了实验Ⅱ中白色固体为 。
。
(3)小组同学对实验Ⅲ中的氧化剂进行了探究和分析。
①甲同学取少量棕色溶液,向其中滴加2滴 溶液,溶液变为红色,由此推断
溶液,溶液变为红色,由此推断 没有参与氧化反应。乙同学认为该推断不合理,理由是
没有参与氧化反应。乙同学认为该推断不合理,理由是___________
②乙同学认为溶液呈棕色与 有关,
有关, 和
和 均参与了氧化反应,请设计简单实验进行验证
均参与了氧化反应,请设计简单实验进行验证___________
【反思评价】
(4)综合上述实验,说明 与
与  的反应与
的反应与___________ 等因素有关。
| 序号 | 实验操作 | 实验现象 |
| Ⅰ | 向盛有 | 铜片部分溶解,溶液变为蓝色 |
| Ⅱ | 向盛有 | 铜片部分溶解,溶液黄色变浅,铜片表面有白色固体出现 |
| Ⅲ | 向盛有 | 铜片部分溶解,溶液变为棕色,实验过程中未见气泡产生 |
ⅰ.氯化亚铜
ⅱ.
【分析解释】
(1)实验Ⅰ中发生反应的离子方程式是
(2)为探究实验Ⅱ中白色固体的组成,小组同学设计并完成了以下实验。
步骤1:取少量洗涤后的白色固体于试管中,向其中滴加稀硝酸,观察到固体溶解,溶液变为蓝色,液面上方有少量红棕色气体生成。
步骤2:向步骤1所得溶液中滴加
①能证明实验Ⅱ白色固体中含有+1价铜的现象是
②步骤2中滴加
通过以上实验,证明了实验Ⅱ中白色固体为
(3)小组同学对实验Ⅲ中的氧化剂进行了探究和分析。
①甲同学取少量棕色溶液,向其中滴加2滴
②乙同学认为溶液呈棕色与
【反思评价】
(4)综合上述实验,说明
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网