解答题-实验探究题 适中0.65 引用1 组卷202
环己烯是重要的化工原料。其实验室制备流程如下:
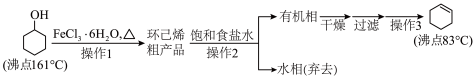
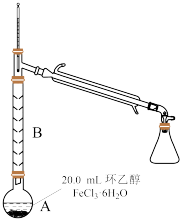
操作1的实验装置如图所示(加热和夹持装置已略去)。
回答下列问题:
(1)烧瓶A中进行反应的化学方程式为_______ ,浓硫酸也可作该反应的催化剂。相比浓硫酸,选择 作催化剂的优点是
作催化剂的优点是_______ (写出一条即可)。
(2)已知环己烯的密度为 ,进行操作2前加饱和食盐水而不加蒸馏水的原因是
,进行操作2前加饱和食盐水而不加蒸馏水的原因是_______ 。
(3)操作2为分液,下列关于分液漏斗的使用,叙述正确的是_______。
(4)操作3(蒸馏)的步骤:安装蒸馏装置,加入待蒸馏的物质和沸石,通冷凝水,加热,弃去前馏分,收集83℃馏分的质量为7.6g,则环己烯的产率为_______ %(已知环己醇的密度为 ,计算结果保留1位小数)。
,计算结果保留1位小数)。

操作1的实验装置如图所示(加热和夹持装置已略去)。

回答下列问题:
(1)烧瓶A中进行反应的化学方程式为
(2)已知环己烯的密度为
(3)操作2为分液,下列关于分液漏斗的使用,叙述正确的是_______。

| A.分液漏斗使用前必须要检漏,只要分液漏斗的旋塞处不漏水即可使用 |
| B.分液时环己烯应从上口倒出 |
| C.振荡萃取操作应如图所示,并打开玻璃塞不断放气 |
| D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔 |
21-22高二下·河南郑州·期末
类题推荐
环己烯可用于生产己二酸、马来酸等物质。实验室制备环己烯的流程如下:
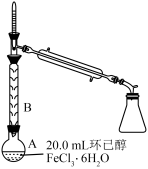
操作1的实验装置如图(加热和夹持装置已略去)。
回答下列问题:
Ⅰ.环己烯的制备和纯化
(1) 中
中 的检验:取一定量的样品配制成溶液,加入
的检验:取一定量的样品配制成溶液,加入___________ 溶液(填化学式),现象为___________ 。
(2)烧瓶A中反应的化学方程式为___________ 。浓硫酸也可作该反应的催化剂,相比浓硫酸,选择 作催化剂的优点是
作催化剂的优点是___________ (写出一条即可)。
(3)仪器B的作用是___________ 。
(4)操作2为分液,下列关于分液漏斗的使用叙述正确的是___________。
(5)操作3为___________ 。
Ⅱ.环己烯含量测定
取a g环己烯产品与 充分反应,剩余的
充分反应,剩余的 与足量KI溶液反应,生成的
与足量KI溶液反应,生成的 用
用 的
的 标准溶液滴定,消耗
标准溶液滴定,消耗 标准溶液
标准溶液 。
。
测定过程中发生的反应如下:
① ②
② ③
③
(6)产品中环己烯的质量分数为___________ 。

操作1的实验装置如图(加热和夹持装置已略去)。

回答下列问题:
Ⅰ.环己烯的制备和纯化
(1)
(2)烧瓶A中反应的化学方程式为
(3)仪器B的作用是
(4)操作2为分液,下列关于分液漏斗的使用叙述正确的是___________。

| A.分液漏斗使用前需检漏,只要分液漏斗旋塞处不漏水即可 |
| B.分液时环己烯应从上口倒出 |
| C.振荡操作应如图所示,并打开玻璃塞不断放气 |
| D.放出液体时,需将玻璃塞打开或使塞上的凹槽对准漏斗口上的小孔 |
Ⅱ.环己烯含量测定
取a g环己烯产品与
测定过程中发生的反应如下:
①
 ②
②(6)产品中环己烯的质量分数为
环己烯是重要的化工原料。其实验室制备与提纯流程如下:
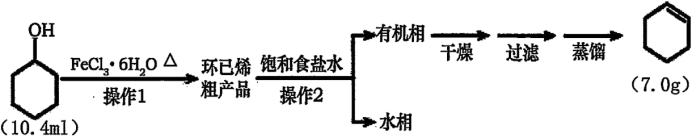
可能用到的有关数据如下:
回答下列问题:
(1)原料环己醇中若含苯酚杂质,检验试剂为___________ ,现象为___________ 。
(2)操作1的装置如图所示(加热和夹持装置已略去)。
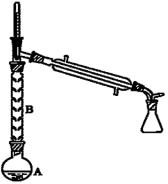
①烧瓶A中进行的可逆反应化学方程式为___________ ,浓硫酸也可作该反应的催化剂,选择 而不用浓硫酸的优点为
而不用浓硫酸的优点为___________ (任答一点即可)。
②加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是___________ 。
(3)下列仪器中,操作2需使用的有___________ (填字母)。
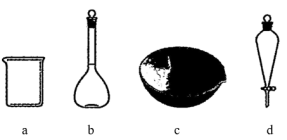
(4)蒸馏操作的正确顺序为___________ (填序号)。
①加热 ②安装装置,加入待蒸馏的物质和沸石
③弃去前馏分,收集83℃的馏分 ④通冷凝水
(5)以下区分环烯纯品和粗品的方法,合理的是___________ (填标号)。
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
(6)根据蒸馏最后得到的产品,计算反应的产率为___________ (只列出计算式)。

可能用到的有关数据如下:
| 名称 | 相对分子质量 | 密度/( | 沸点/℃ | 溶解性 |
| 环己醇 | 100 | 0.96 | 161 | 能溶于水 |
| 环己烯 | 82 | 0.81 | 83 | 难溶于水 |
(1)原料环己醇中若含苯酚杂质,检验试剂为
(2)操作1的装置如图所示(加热和夹持装置已略去)。

①烧瓶A中进行的可逆反应化学方程式为
②加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是
(3)下列仪器中,操作2需使用的有

(4)蒸馏操作的正确顺序为
①加热 ②安装装置,加入待蒸馏的物质和沸石
③弃去前馏分,收集83℃的馏分 ④通冷凝水
(5)以下区分环烯纯品和粗品的方法,合理的是
A.用酸性高锰酸钾溶液 B.用金属钠 C.测定沸点
(6)根据蒸馏最后得到的产品,计算反应的产率为
环己酮是一种重要的有机化工原料。实验室合成环己酮的反应如下:
现以20mL环己醇与足量Na2Cr2O7和硫酸的混合液充分反应,制得主要含环己酮和水的粗产品,然后进行分离提纯。其主要步骤有(未排序):
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是______________ 。
(2)b中水层用乙醚萃取的目的是_________________ 。
(3)以下关于萃取分液操作的叙述中,不正确的是 。
(4)在上述操作d中,加入NaCl固体的作用是______________ 。蒸馏除乙醚的操作中,采用的加热方式为___________ 。
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是________ 。
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是_____ (保留两位有效数字)。
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g·cm—3、20 ℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
a.蒸馏、除去乙醚后,收集151℃~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量水
回答下列问题:
(1)上述分离提纯步骤的正确顺序是
(2)b中水层用乙醚萃取的目的是
(3)以下关于萃取分液操作的叙述中,不正确的是 。
A.水溶液中加入乙醚,转移至分液漏斗,塞上玻璃塞,如图( )用力振荡 )用力振荡 |
| B.振荡几次后需打开分液漏斗上口的玻璃塞放气 |
| C.经几次振荡并放气后,手持分漏斗静置液体分层 |
| D.分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞,待下层液体全部流尽时,再从上口倒出上层液体 |
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是
(6)恢复至室温时,分离得到纯产品体积为12mL,则环己酮的产率约是
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


