解答题-结构与性质 适中0.65 引用1 组卷180
H与O可以形成H2O和H2O2两种化合物。请回答:
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为_____ 。
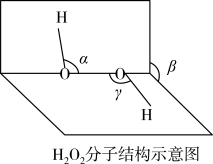
(2)H2O2分子结构如图所示,α、β、γ中相等的角是_____ ,H2O2是_____ 分子(填“极性”或“非极性”)。H2O2晶体中有4种作用力:①O-O键、②O-H键、③范德华力、④氢键,这4种作用力由强到弱依次为:_____ (用序号表示)。
(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是_____ 。
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是_____ (运用物质结构原理解释)。
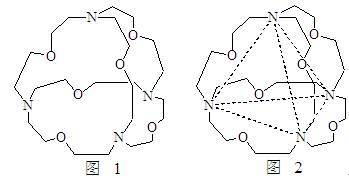
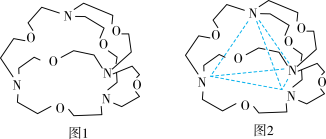
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_____ (填标号)。
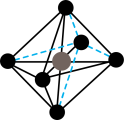
(6)SF6分子的空间结构为正八面体形,如图所示。1molSF6中含有_____ molS-F键,它的二氯代物SF4Cl2有_____ 种。
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为
(2)H2O2分子结构如图所示,α、β、γ中相等的角是

(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

| A.CCl4 | B.CH4 | C.NH | D.H2O |

22-23高二上·湖北武汉·阶段练习
类题推荐
氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是_________________ 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为_____ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4与硫酸铵晶体类型相同,则N2H6SO4的晶体内不存在____ 。
a.离子键 b. 共价键 c. 配位键 d. 范德华力
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是__________ 。KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是______________ 。
(4)美国科学家合成了结构呈“V”形对称的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是_______________________。
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。
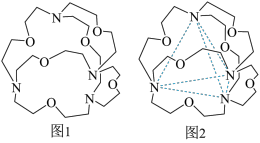
下列分子或离子中,能被该有机化合物识别的是_________ (填标号)。
a.CF4 b.CH4 c.NH4+ d.H2O
(6)N的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为________ 形,阳离子中氮的杂化方式为_________ 。
(1)基态氮原子的价电子排布式是
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4与硫酸铵晶体类型相同,则N2H6SO4的晶体内不存在
a.离子键 b. 共价键 c. 配位键 d. 范德华力
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是
(4)美国科学家合成了结构呈“V”形对称的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是_______________________。
| A.每个N5+中含有35个质子和36个电子 |
| B.该离子中有非极性键和配位键 |
| C.该离子中含有2个π键 |
| D.与PCl4+互为等电子体 |

下列分子或离子中,能被该有机化合物识别的是
a.CF4 b.CH4 c.NH4+ d.H2O
(6)N的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网