解答题-原理综合题 适中0.65 引用2 组卷217
水溶液中的行为是中学化学的重要内容。
(1)在某温度(T℃)的水溶液中,c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x与y关系如图所示。
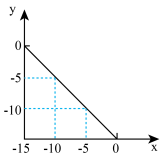
将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为______ (已知lg5=0.7)
(2)已知部分弱酸的电离常数如表:
①0.1mol•L-1NaCN溶液和0.1mol•L-1NaHCO3溶液中,c(CN-)______ c(HCO )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
②常温下,pH相同的三种溶液:a.CH3COONa、b.NaCN、c.Na2CO3,其物质的量浓度由大到小的顺序是______ 。(填序号)
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。
①25℃时,FeCl3溶液显酸性,原因是(用离子方程式表示)______ ,把FeCl3溶液蒸干灼烧得到的主要产物是______ ;
②某腐蚀废液中含有0.5mol•L-1Fe3+和0.26mol•L-1Cu2+,欲使Fe3+完全沉淀【c(Fe3+)≤4×10-5mol•L-1】而Cu2+不沉淀,则需控制溶液pH的范围为______ 。【KspCu(OH)2=2.6×10-19;KspFe(OH)3=4×10-38】
(1)在某温度(T℃)的水溶液中,c(H+)=10xmol•L-1,c(OH-)=10ymol•L-1,x与y关系如图所示。

将此温度下pH=11的NaOH溶液与pH=1的HCl溶液等体积混合,混合后溶液的pH约为
(2)已知部分弱酸的电离常数如表:
| 弱酸 | CH3COOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.8×10-5 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
②常温下,pH相同的三种溶液:a.CH3COONa、b.NaCN、c.Na2CO3,其物质的量浓度由大到小的顺序是
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。
①25℃时,FeCl3溶液显酸性,原因是(用离子方程式表示)
②某腐蚀废液中含有0.5mol•L-1Fe3+和0.26mol•L-1Cu2+,欲使Fe3+完全沉淀【c(Fe3+)≤4×10-5mol•L-1】而Cu2+不沉淀,则需控制溶液pH的范围为
22-23高二上·天津·期末
类题推荐
水是一种很好的溶剂,也是物质发生化学反应的主要介质。大自然的馈赠——喀斯特地貌即是因化学反应经千万年而形成的。水中世界千千万,它与我们的生活、生产密切相关,请用所学知识,解决下列问题。
(1)常温下,有 的四种溶液:①
的四种溶液:① ②
② ③
③ ④
④
a.任选上述一种酸性溶液,用化学用语解释其呈酸性的原因___________ 。
b.溶液①中由水电离出的氢氧根离子浓度为___________  。
。
c.溶液①、③等体积混合后,溶液中
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)在某温度(T℃)的水溶液中, ,
, ,x与y关系如图所示。
,x与y关系如图所示。
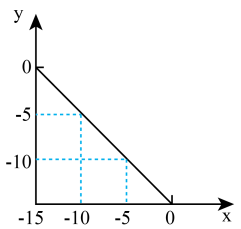
该温度下,水的离子积为___________ ,T℃___________ 25℃(填“>”“<”或“=”)。将此温度下 的
的 溶液与
溶液与 的
的 溶液等体积混合,混合后溶液的
溶液等体积混合,混合后溶液的 约为
约为___________ (已知 )
)
(3)已知部分弱酸的电离常数如表:
则:① 溶液和
溶液和 溶液中,
溶液中,
___________  (填“>”“<”或“=”)
(填“>”“<”或“=”)
②常温下, 相同的三种溶液:a.
相同的三种溶液:a. 、b.
、b. 、c.
、c. ,其物质的量浓度由大到小的顺序是
,其物质的量浓度由大到小的顺序是___________ (填序号)
③将少量 通入
通入 溶液,反应的离子方程式是
溶液,反应的离子方程式是___________ 。
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有 和
和 ,欲常温时使
,欲常温时使 完全沉淀[c(Fe3+)≤4×10-5mol/L]而
完全沉淀[c(Fe3+)≤4×10-5mol/L]而 不沉淀,则需控制溶液
不沉淀,则需控制溶液 的范围为
的范围为___________ 。[已知: ;
; ]
]
(1)常温下,有
a.任选上述一种酸性溶液,用化学用语解释其呈酸性的原因
b.溶液①中由水电离出的氢氧根离子浓度为
c.溶液①、③等体积混合后,溶液中
(2)在某温度(T℃)的水溶液中,

该温度下,水的离子积为
(3)已知部分弱酸的电离常数如表:
| 弱酸 | |||
| 电离常数(25℃) |
②常温下,
③将少量
(4)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有
电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表
①室温下,一定浓度的HCOONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是_______ 。
②0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,c(CN-)_______ c(HCO )(填“>”、“<”或“=”)。
)(填“>”、“<”或“=”)。
③常温下,pH相同的三种溶液a、HCOONab、NaCNc、Na2CO3,其物质的量浓度由大到小的顺序是_______ (填编号)。
④将少量CO2通入NaCN溶液,反应的离子方程式是_______ 。
(2)室温下,用0.100mol·L-1盐酸溶液滴定20.00mL0.100mol·L-1的某氨水溶液,滴定曲线如图所示:
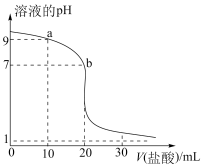
①b点液中离子浓度大小的关系式为_______ 。
②a点所示的溶液中电荷守恒式为_______ 。
(3)已知Ksp(BaCO3)=2.6×10-9,Ksp(BaSO4)=1.1×10-10
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______ mol·L-1
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
_______ (保留三位有效数字)。
(1)已知部分弱酸的电离常数如下表
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离常数(25℃) | Ka=1.77×10-4 | Ka=4.3×10-10 | Ka1=5.0×10-7 Ka2=5.6×10-11 |
①室温下,一定浓度的HCOONa溶液pH=9,用离子方程式表示溶液呈碱性的原因是
②0.1mol·L-1NaCN溶液和0.1mol·L-1NaHCO3溶液中,c(CN-)
③常温下,pH相同的三种溶液a、HCOONab、NaCNc、Na2CO3,其物质的量浓度由大到小的顺序是
④将少量CO2通入NaCN溶液,反应的离子方程式是
(2)室温下,用0.100mol·L-1盐酸溶液滴定20.00mL0.100mol·L-1的某氨水溶液,滴定曲线如图所示:

①b点液中离子浓度大小的关系式为
②a点所示的溶液中电荷守恒式为
(3)已知Ksp(BaCO3)=2.6×10-9,Ksp(BaSO4)=1.1×10-10
①现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为
②向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


