解答题-原理综合题 适中0.65 引用1 组卷35
Ⅰ.将气体A、B置于固定容积为4L的密闭容器中,发生如下反应:2A(g)+B(g) C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
(1)用生成物C表示20s内的平均反应速率为_________________ mol/(L·s)。
(2)反应前A的物质的量浓度是________________ mol/L。
(3)反应达平衡时,B的转化率为________________ 。
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
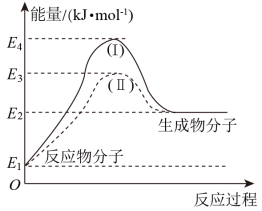
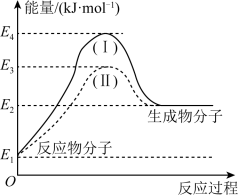
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
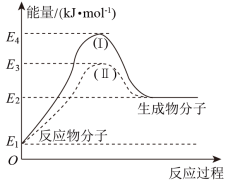
(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
 C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:
C(g)+2D(g),反应进行20s后达到平衡,测得平衡时A的物质的量为0.16mol,B的物质的量为0.06mol,C的物质的量为0.04mol,请计算并回答:(1)用生成物C表示20s内的平均反应速率为
(2)反应前A的物质的量浓度是
(3)反应达平衡时,B的转化率为
(4)若改变下列条件,D的生成速率如何变化(用“增大”或“减小”或“不变”填空)。
| 编号 | 改变的条件 | D的生成速率 |
| ① | 降低体系温度 | |
| ② | 恒容下补充A气体 | |
| ③ | 恒容下充入Ne(不参与体系反应) |
Ⅱ.氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

(5)通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
(6)图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
(7)已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
则∆H2=
21-22高二上·广东潮州·阶段练习
类题推荐
甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g) CH3OH(g) △H3=-90.77 kJ•mol-1
CH3OH(g) △H3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________ ,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________ (用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________ (填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
①T______ 500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________ ;
b.该温度下,反应I的平衡常数K=______________ 。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
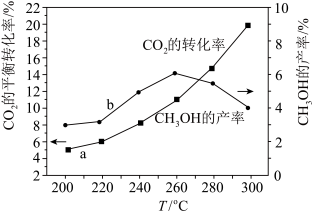
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____ (选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________ (填“增大”、“减小”、“不变”或“无法判断”)。
反应Ⅰ:CO2(g)+3H2(g)
反应Ⅱ:CO2(g)+H2(g)
反应Ⅲ:CO(g)+2H2(g)
回答下列问题:
(1)反应Ⅱ的△H2=
(2)反应Ⅲ自发进行条件是
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
| 温度(℃) | 500 | T |
| CO2的平衡转化率 | 60℅ | 40℅ |
①T
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为
b.该温度下,反应I的平衡常数K=
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。

①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网