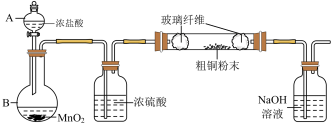
解答题-工业流程题 困难0.15 引用1 组卷806
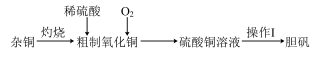
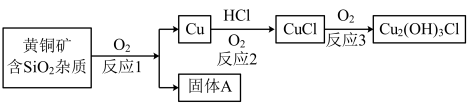
铜是人类最早冶炼的金属之一、在地壳中,铜主要以硫化物、氧化物或碳酸盐形式存在,其主要矿石为黄铜矿( )、辉铜矿(
)、辉铜矿( )、铜矿(
)、铜矿( )和孔雀石(
)和孔雀石( )。尽管地壳中铁的丰度高于铜,但人类发展炼铁技术的时间较晚。有关铜及其化合物转化的部分工业流程(或转化关系)如下:
)。尽管地壳中铁的丰度高于铜,但人类发展炼铁技术的时间较晚。有关铜及其化合物转化的部分工业流程(或转化关系)如下: (黑色)、
(黑色)、 (红棕色)、碱式硫酸铜(蓝绿色,如
(红棕色)、碱式硫酸铜(蓝绿色,如 、
、 )等。生锈使青铜器的表面呈现出最显著的特征。这一层通常不会改变青铜器的形状,而且铜绿的性质相对稳定,因此通常不会损坏青铜器。然而,如果青铜与含氯物质接触,则可能会形成
)等。生锈使青铜器的表面呈现出最显著的特征。这一层通常不会改变青铜器的形状,而且铜绿的性质相对稳定,因此通常不会损坏青铜器。然而,如果青铜与含氯物质接触,则可能会形成 和
和 ,这被称为“粉末锈病”,这种铜锈会通过以下反应引起“青铜病”:
,这被称为“粉末锈病”,这种铜锈会通过以下反应引起“青铜病”: 与
与 和
和 反应,产生
反应,产生 和
和 (反应3)。形成的
(反应3)。形成的 不是致密相,进而
不是致密相,进而 穿透松散相,与
穿透松散相,与 结合并侵蚀
结合并侵蚀 ,从而形成
,从而形成 和
和 (反应2)。这些反应反复发生,直到器皿完全损坏。
(反应2)。这些反应反复发生,直到器皿完全损坏。
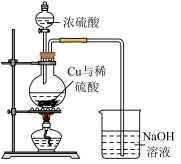
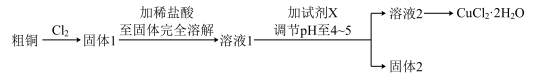
可以从废青铜( 合金)中制备胆矾(
合金)中制备胆矾( )。称取一定量的青铜废料,放入烧杯中,在通风橱中小心地向烧杯中加入浓硝酸。在反应过程中,释放出红棕色气体(B),形成蓝绿色溶液(C)与白色沉淀(D)的混合物。过滤后,向滤液中添加
)。称取一定量的青铜废料,放入烧杯中,在通风橱中小心地向烧杯中加入浓硝酸。在反应过程中,释放出红棕色气体(B),形成蓝绿色溶液(C)与白色沉淀(D)的混合物。过滤后,向滤液中添加 水溶液,然后形成蓝色溶液E和白色沉淀F。浓缩溶液E和蓝色微晶(晶粒),冷却溶液可获得粗产物(G)。
水溶液,然后形成蓝色溶液E和白色沉淀F。浓缩溶液E和蓝色微晶(晶粒),冷却溶液可获得粗产物(G)。
回答下面问题:
(1)写出反应2~3的化学方程式__________ 。
(2)已知在反应1过程中 所有元素化合价都发生了改变,写出固体A的化学式
所有元素化合价都发生了改变,写出固体A的化学式__________ 。
(3)写出B、D、F和G的化学式__________ 。
(4)分别写出溶液C和E中的主要阴离子和阳离子__________ 。
(5)为了测试产品纯度,称量0.2765g样品至250mL碘量瓶中,并用缓冲溶液溶解。向烧瓶中添加1g ,摇晃10秒后,将混合物在黑暗中保持10分钟。加水稀释后,用0.05036mol·L-1
,摇晃10秒后,将混合物在黑暗中保持10分钟。加水稀释后,用0.05036mol·L-1 标准溶液滴定,滴定终点时消耗20.80mL标准溶液,求出产物的纯度(质量分数)
标准溶液滴定,滴定终点时消耗20.80mL标准溶液,求出产物的纯度(质量分数) __________ 。
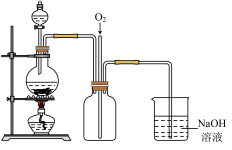
(6)对 进行了热重分析,其重量随温度的变化如下图所示,求出过程中先后得到的三种固体的化学式
进行了热重分析,其重量随温度的变化如下图所示,求出过程中先后得到的三种固体的化学式__________ 。
可以从废青铜(
回答下面问题:
(1)写出反应2~3的化学方程式
(2)已知在反应1过程中
(3)写出B、D、F和G的化学式
(4)分别写出溶液C和E中的主要阴离子和阳离子
(5)为了测试产品纯度,称量0.2765g样品至250mL碘量瓶中,并用缓冲溶液溶解。向烧瓶中添加1g
(6)对

2023·辽宁·一模
类题推荐
硫酸亚铁铵[Fe(NH4)2(SO4)2·6H2O]俗称摩尔盐,是一种蓝绿色固体,易溶于水,不溶于乙醇,在100℃~ 110℃时受热分解,可用于电镀。实验小组利用工业废铁屑制取摩尔盐、测定其纯度并探究其热分解产物。
回答下列问题:
I.摩尔盐的制备
实验室制取摩尔盐的实验过程如图所示:
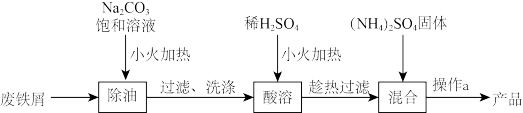
(1)Na2CO3饱和溶液能除去废铁屑表面的油污,是因为该溶液显_______ (填“酸性”“碱性” 或“中性”)。“酸溶” 时需加入过量废铁屑,目的是_______ 。 最后制得产品的“ 操作a”包括加热浓缩、_______ 、过滤、洗涤、干燥等步骤。
II.摩尔盐的纯度测定
称取4.0g上述实验所得产品,在烧杯中加适量蒸馏水溶解后再加入适量稀硫酸,配制成100 mL溶液,取25.00 mL所配溶液,用0.05 mol/L KMnO4溶液重复滴定三次,平均消耗KMnO4溶液10.00 mL。
(2)滴定时发生反应的离子方程式是_______ ,该产品的纯度为_______ %(结果保留至小数点后1位)。
III.探究摩尔盐的热分解产物
[查阅资料]相关物质的熔、沸点如下表: 。
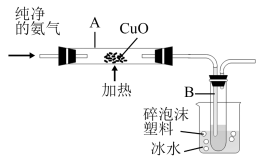
三个实验小组分别按下图装置进行相关实验(部分夹持仪器已略去) :

各小组在E装置中盛装不同溶液,实验现象如下:
此外,均观察到A中固体变为红棕色,C中固体颜色不变,D中得到无色固体。
(3)C中无水硫酸铜的作用是_______ 。
(4)E中进气管只浸入液面少许,其目的是_____ 。第1组实验,E中产生的白色沉淀为_____ (填化学式) ;第3组实验,E中产生白色沉淀的离子方程式为_______ 。
(5)根据上述实验现象,推测摩尔盐受热分解反应的化学方程式为_______ 。
回答下列问题:
I.摩尔盐的制备
实验室制取摩尔盐的实验过程如图所示:

(1)Na2CO3饱和溶液能除去废铁屑表面的油污,是因为该溶液显
II.摩尔盐的纯度测定
称取4.0g上述实验所得产品,在烧杯中加适量蒸馏水溶解后再加入适量稀硫酸,配制成100 mL溶液,取25.00 mL所配溶液,用0.05 mol/L KMnO4溶液重复滴定三次,平均消耗KMnO4溶液10.00 mL。
(2)滴定时发生反应的离子方程式是
III.探究摩尔盐的热分解产物
[查阅资料]相关物质的熔、沸点如下表: 。
| 物质 | SO2 | SO3 | NH3 |
| 熔点/℃ | -76 | 16.8 | -77.8 |
| 沸点/℃ | -10 | 44.8 | -33.5 |

各小组在E装置中盛装不同溶液,实验现象如下:
| 小组编号 | 溶液 | 实验现象 |
| 1 | BaCl2溶液 | 产生白色沉淀 |
| 2 | HCl和BaCl2混合溶液 | 不产生白色沉淀 |
| 3 | H2O2和BaCl2混合溶液 | 产生白色沉淀 |
(3)C中无水硫酸铜的作用是
(4)E中进气管只浸入液面少许,其目的是
(5)根据上述实验现象,推测摩尔盐受热分解反应的化学方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网