解答题-工业流程题 适中0.65 引用1 组卷128
综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4、钛酸亚铁FeTiO3]获得钛白(TiO2)和单质镓,再由镓(Ga)制取具有优异光电性能的氮化镓,部分工艺流程如图:
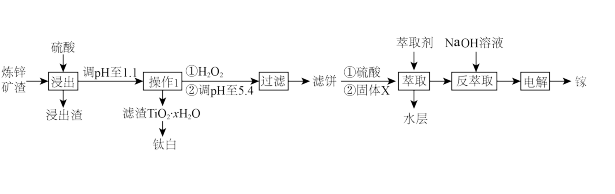
已知:①镓和铝同主族,化学性质相似;
②酸浸时,钛元素以TiO2+形式存在,室温下TiO2+极易水解;
③常温下,浸出液中各金属元素的离子形成氢氧化物沉淀的pH见表1;
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1 金属元素的离子形成氢氧化物沉淀的pH
表2 金属离子的萃取率
(1)Ga2(Fe2O4)3中Fe元素的化合价为_______ ,“浸出”时FeTiO3发生反应的离子方程式为_______ 。
(2)滤饼的主要成分是_______ ;萃取前加入的固体X为_______ (填标号)。
A. Fe B. C.
C.  D.
D. 
(3)电解反萃取液可制粗镓,则阴极得到金属镓的电极反应式为_______ 。
(4)测定钛白中TiO2的含量可用滴定分析法:取1.000g样品充分溶于过量硫酸中,使TiO2转化为TiO2+,加入铝粉将TiO2+充分还原[ (未配平)]。过滤后,将滤液用稀硫酸稀释至100mL。取20mL于锥形瓶中,滴加2~3滴指示剂,用0.1000 mol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作两次,平均消耗NH4Fe(SO4)2标准溶液22.00mL。
(未配平)]。过滤后,将滤液用稀硫酸稀释至100mL。取20mL于锥形瓶中,滴加2~3滴指示剂,用0.1000 mol/L的NH4Fe(SO4)2标准溶液进行滴定(Fe3+能将Ti3+氧化成四价钛的化合物),重复上述滴定操作两次,平均消耗NH4Fe(SO4)2标准溶液22.00mL。
①上述滴定过程中使用的指示剂为_______ 。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则TiO2的含量测定结果_______ (填“偏高”“偏低”或“无影响”)
③钛白中TiO2质量分数为_______ 。
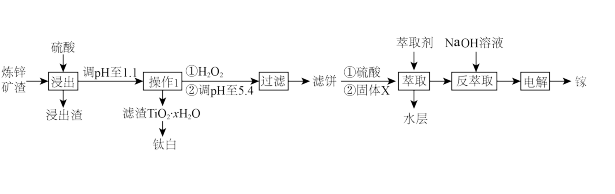
已知:①镓和铝同主族,化学性质相似;
②酸浸时,钛元素以TiO2+形式存在,室温下TiO2+极易水解;
③常温下,浸出液中各金属元素的离子形成氢氧化物沉淀的pH见表1;
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表2。
表1 金属元素的离子形成氢氧化物沉淀的pH
| 金属元素的离子 | Fe2+ | TiO2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 7.6 | 0.4 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 1.1 | 3.2 | 8.0 | 4.9 |
表2 金属离子的萃取率
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)Ga2(Fe2O4)3中Fe元素的化合价为
(2)滤饼的主要成分是
A. Fe B.
(3)电解反萃取液可制粗镓,则阴极得到金属镓的电极反应式为
(4)测定钛白中TiO2的含量可用滴定分析法:取1.000g样品充分溶于过量硫酸中,使TiO2转化为TiO2+,加入铝粉将TiO2+充分还原[
①上述滴定过程中使用的指示剂为
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则TiO2的含量测定结果
③钛白中TiO2质量分数为
21-22高三下·湖南长沙·阶段练习
类题推荐
综合利用炼锌矿渣[主要含铁酸镓 、铁酸锌
、铁酸锌 、偏钛酸亚铁
、偏钛酸亚铁 ]获得钛白(
]获得钛白( )和单质镓,部分工艺流程如图
)和单质镓,部分工艺流程如图
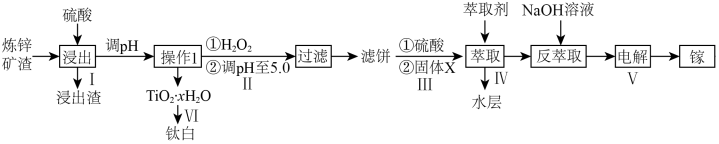
已知:①镓和铝同主族,化学性质相似;
②常温下, ,
, ,
, ;
;
③酸浸时,钛元素以 形式存在,室温下
形式存在,室温下 极易水解;
极易水解;
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见下表。
(1)步骤Ⅰ,“浸出”时 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)下列有关说法正确的是___________ 。
A.步骤Ⅰ:将炼锌矿渣粉碎和适当提高硫酸浓度提高浸出速率
B.操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作
C.步骤Ⅱ,调节pH的目的是沉淀 和
和
D.步骤Ⅳ,加大萃取剂用量,一次完成萃取以提高萃取效率
E.步骤Ⅴ,溶液直接电解制得粗镓的电极反应式为
(3)步骤Ⅲ,固体X最好选用___________ ,理由是___________ 。
(4)步骤Ⅵ,实验需使用的仪器为___________(填标号)
(5)测定钛白中 的含量可用滴定分析法:称取mg样品放入锥形瓶中,加入
的含量可用滴定分析法:称取mg样品放入锥形瓶中,加入 和
和 混合溶液,加热使样品溶解。冷却后,加入足量稀盐酸(Ti元素存在形式变为
混合溶液,加热使样品溶解。冷却后,加入足量稀盐酸(Ti元素存在形式变为 )。加入过量铝粉将
)。加入过量铝粉将 充分还原[
充分还原[ (未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的
(未配平)],待过量金属铝完全溶解并冷却后,滴加2~3滴指示剂,用cmol/L的 标准溶液进行滴定(
标准溶液进行滴定( 能将
能将 氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗
氧化成四价钛的化合物),重复上述滴定操作2~3次,平均消耗 标准溶液VmL。
标准溶液VmL。
①过量铝粉的作用除了还原 外,另一个作用是
外,另一个作用是___________ 。
②上述滴定过程中应选用指示剂为___________ 。
③下列关于滴定分析的操作,不正确 的是___________ 。
A.用托盘天平称量 样品mg
样品mg
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得 的含量测定结果偏高
的含量测定结果偏高
④钛白中 质量分数为
质量分数为___________ 。(写出最简表达式即可)。

已知:①镓和铝同主族,化学性质相似;
②常温下,
③酸浸时,钛元素以
④金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见下表。
| 金属离子 | ||||
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)步骤Ⅰ,“浸出”时
(2)下列有关说法正确的是
A.步骤Ⅰ:将炼锌矿渣粉碎和适当提高硫酸浓度提高浸出速率
B.操作1包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作
C.步骤Ⅱ,调节pH的目的是沉淀
D.步骤Ⅳ,加大萃取剂用量,一次完成萃取以提高萃取效率
E.步骤Ⅴ,溶液直接电解制得粗镓的电极反应式为
(3)步骤Ⅲ,固体X最好选用
(4)步骤Ⅵ,实验需使用的仪器为___________(填标号)
A. | B. | C. | D. |
(5)测定钛白中
①过量铝粉的作用除了还原
②上述滴定过程中应选用指示剂为
③下列关于滴定分析的操作,
A.用托盘天平称量
B.滴定管用蒸馏水洗涤时,洗涤液应从滴定管下端放出
C.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
D.读数时应将滴定管从架上取下,捏住管上端无刻度处,使滴定管保持垂直
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得
④钛白中
综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:
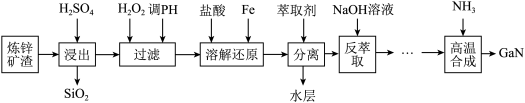
已知:常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表。
请回答:
(1)写出铁酸锌(ZnFe2O4) 中铁元素的化合价_______ 。
(2)Ga位于周期表IIIA族,性质与Al相似,反萃取后水溶液中镓元素以_______ (用化学式表示)存在。
(3)处理浸出液时,调节pH至5.4的目的是_______ 。
(4)加入铁的原因为_______ 。
(5)写出“高温合成”操作中Ga(CH3)3与NH3反应生成GaN的化学方程式_______ 。
(6)利用炼锌矿矿渣所获得的三种金属盐,分别为镓盐、_______ 和_______ 。(用化学式表示)
(7)取一定量GaN样品溶于足量的热NaOH溶液中,用H3BO3溶液将产生的NH3完全吸收,用标准浓度的盐酸滴定,通过消耗盐酸的体积,可测定样品的纯度。已知:NH3+ H3BO3= NH3·H3BO3;NH3·H3BO3 +HCl= NH4Cl+H3BO3,硼酸的Ka=10-9.24,从滴定角度分析可用过量H3BO3溶液吸收NH3的可能原因是_______ 。

已知:常温下,浸出液中各离子形成氢氧化物沉淀的pH和金属离子在工艺条件下的萃取率(进入有机层中金属离子的百分数)见表。
| 金属离子 | Fe2+ | Fe3+ | Zn2+ | Ga3+ |
| 开始沉淀pH | 8.0 | 1.7 | 5.5 | 3.0 |
| 沉淀完全pH | 9.6 | 3.2 | 8.0 | 4.9 |
| 萃取率(%) | 0 | 99 | 0 | 97~98.5 |
(1)写出铁酸锌(ZnFe2O4) 中铁元素的化合价
(2)Ga位于周期表IIIA族,性质与Al相似,反萃取后水溶液中镓元素以
(3)处理浸出液时,调节pH至5.4的目的是
(4)加入铁的原因为
(5)写出“高温合成”操作中Ga(CH3)3与NH3反应生成GaN的化学方程式
(6)利用炼锌矿矿渣所获得的三种金属盐,分别为镓盐、
(7)取一定量GaN样品溶于足量的热NaOH溶液中,用H3BO3溶液将产生的NH3完全吸收,用标准浓度的盐酸滴定,通过消耗盐酸的体积,可测定样品的纯度。已知:NH3+ H3BO3= NH3·H3BO3;NH3·H3BO3 +HCl= NH4Cl+H3BO3,硼酸的Ka=10-9.24,从滴定角度分析可用过量H3BO3溶液吸收NH3的可能原因是
综合利用炼锌矿渣[主要含铁酸镓Ga2(Fe2O4)3、铁酸锌ZnFe2O4]可获得3种金属盐,并进一步利用镓盐制备具有优异光电性能的氮化镓(GaN),部分工艺流程如下:

已知:①常温下,浸出液中各离子的浓度及开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中的金属离子百分数)见表2。
表1 金属离子浓度及开始沉淀的pH
表2金属离子的萃取率
(1)Ga2(Fe2O4)3中Fe的化合价为______ ,“操作1”为______ 。
(2)“滤液1”中可回收利用的物质是______ 。“滤饼”的主要成分是______ 。“萃取”前加入的固体X为______ 。
(3)Ga与Al同主族,化学性质相似。“反萃取”后,镓的存在形式为______ (填化学式)。
(4)GaN可采用“MOCVD(金属有机物化学气相淀积)技术”制得:以合成的三甲基镓[Ga(CH3)3]为原料,在一定条件下使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为______ 。
(5)下图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______ (填“左”或“右”)池移动;铜电极上发生反应的电极反应式为______ 。


已知:①常温下,浸出液中各离子的浓度及开始形成氢氧化物沉淀的pH见表1。
②金属离子在工艺条件下的萃取率(进入有机层中的金属离子百分数)见表2。
表1 金属离子浓度及开始沉淀的pH
| 金属离子 | 浓度/mol·L-1) | 开始沉淀的pH |
| Fe2+ | 1.0×10-3 | 8.0 |
| Fe3+ | 4.0×10-2 | 1.7 |
| Zn2+ | 1.5 | 5.5 |
| Ga3+ | 3.0×10-3 | 3.0 |
表2金属离子的萃取率
| 金属离子 | 萃取率/% |
| Fe2+ | 0 |
| Fe3+ | 99 |
| Z2+ | 0 |
| Ga3+ | 97~98.5 |
(1)Ga2(Fe2O4)3中Fe的化合价为
(2)“滤液1”中可回收利用的物质是
(3)Ga与Al同主族,化学性质相似。“反萃取”后,镓的存在形式为
(4)GaN可采用“MOCVD(金属有机物化学气相淀积)技术”制得:以合成的三甲基镓[Ga(CH3)3]为原料,在一定条件下使其与NH3发生反应得到GaN和另一种产物,该过程的化学方程式为
(5)下图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


