填空题 适中0.65 引用3 组卷161
碘化钾和碘酸钾(KIO3)在食品工业中常用作营养增补剂(碘值强化剂),我国从1994年起在食盐中添加碘酸钾作为补碘剂。
(1)为检验某食盐中所加碘强化剂是碘化钾或碘酸钾,现进行分步实验:
已知:Ⅰ.氧化性 ;
;
Ⅱ.实验中可选用的试剂有:FeCl3溶液、FeSO4溶液、淀粉溶液
①补充完整检验食盐中是否含有I-的实验方案:取少量食盐,加水溶解,_______ 。
②补充完整检验食盐中是否含有 的实验方案:取少量食盐,加水溶解,
的实验方案:取少量食盐,加水溶解,_______ 。
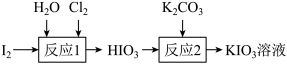
(2)工业可用“氯酸钾氧化法”分两步制备KIO3,其中第一步反应方程式为:
①用单线桥表示该反应电子转移的方向和数目:_______ 。
②每生成标准状况下11.2LCl2,反应转移电子的物质的量是_______ 。
③第二步反应时应向 中加入的物质是
中加入的物质是_______ 。
(1)为检验某食盐中所加碘强化剂是碘化钾或碘酸钾,现进行分步实验:
已知:Ⅰ.氧化性
Ⅱ.实验中可选用的试剂有:FeCl3溶液、FeSO4溶液、淀粉溶液
①补充完整检验食盐中是否含有I-的实验方案:取少量食盐,加水溶解,
②补充完整检验食盐中是否含有
(2)工业可用“氯酸钾氧化法”分两步制备KIO3,其中第一步反应方程式为:
①用单线桥表示该反应电子转移的方向和数目:
②每生成标准状况下11.2LCl2,反应转移电子的物质的量是
③第二步反应时应向
22-23高一上·江苏南通·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网