填空题 较易0.85 引用1 组卷83
试从化学键的角度理解化学反应中的能量变化。(以2H2+O2=2H2O为例说明),已知:E反表示反应物(2H2+O2)所具有的总能量,E生表示生成物(2H2O)所具有的总能量。又知:拆开1moL H2中的化学键需要吸收436kJ能量,拆开1moL O2中的化学键需要吸收496kJ能量,形成水分子中的1moLH-O键能够释放463kJ能量。
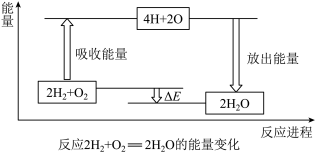
(1)宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应_______ (填“吸收”或“放出”)能量。
(2)微观角度看:断裂反应物中的化学键吸收的总能量为E吸 =_______ kJ; 形成生成物中的化学键放出的总能量为E放=_______ kJ。E吸_______ E放(填“>”或“<”),所以该反应要_______ (填“吸收”或“放出”)能量,能量变化值的大小△E=_______ kJ(填数值)

(1)宏观角度看:反应物所具有的总能量高于生成物所具有的总能量,所以该反应
(2)微观角度看:断裂反应物中的化学键吸收的总能量为E吸 =
20-21高一下·湖南邵阳·阶段练习
类题推荐
从微观角度理解反应热的实质
以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:
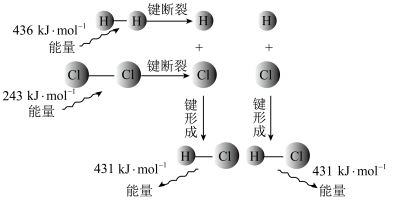
由图可知:
①图示:化学反应过程中形成化学键、断裂化学键能量变化可用如图表示:

其中,_____ 表示反应物断裂化学键吸收的总热量,_____ 表示生成物形成化学键放出的总热量,E1与E2的差值表示_____ 。上述反应过程表示该反应为_____ 反应。
②焓变计算公式:ΔH=E总(断键)-E总(成键)
以H2(g)+Cl2(g)=2HCl(g)反应的能量变化为例说明,如图所示:

由图可知:
| 化学键 | 反应中能量变化 | |
| 断裂或形成1mol化学键的能量变化 | 断裂或形成化学键的总能量变化 | |
| H—H | 吸收 | 共吸收 |
| Cl—Cl | 吸收 | |
| H—Cl | 放出 | 共放出 |
| 结论 | H2(g)+Cl2(g)=2HCl(g)的反应热ΔH= | |

其中,
②焓变计算公式:ΔH=E总(断键)-E总(成键)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网



