解答题-原理综合题 适中0.65 引用1 组卷30
回答下列问题
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_______
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为_______ ,若分别用这三种酸中和含等物质的量NaOH的溶液,所需酸溶液的体积分别为a、b、c,则a、b、c的大小关系是_______ 。
(3)NaHSO3溶液显酸性的原因是_______ (用化学用语和必要的文字说明)。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为_______ 。
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是_______ (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
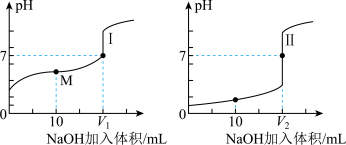
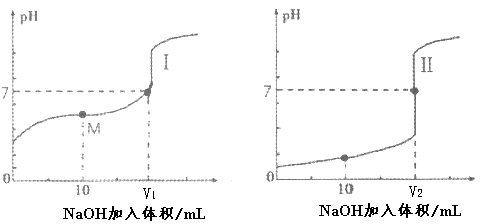
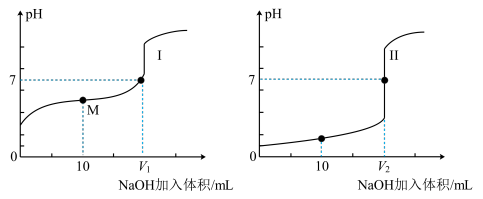
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是_______ 。
(1)工业上以NH3、CO2为原料生产尿素[CO(NH2)2],该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:
(2)有pH均为2的CH3COOH、HCl、H2SO4 三种物质的溶液,物质的量浓度由大到小的顺序为
(3)NaHSO3溶液显酸性的原因是
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为
(5)下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是
a.滴加少量浓盐酸 b.微热溶液 c.加入少量醋酸钠晶体
(6)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。图中M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是

21-22高二上·湖北十堰·阶段练习
类题推荐
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=______ 。
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为____ 。
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为____ 。
(4)25℃时,向0.1 mol•L-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是______ 。
A. B.
B.
C. D.
D.
(5)能证明醋酸是弱酸的实验事实是______ (填写序号)。
① 相同条件下,浓度均为0.1 mol•L-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1mol•L-1 CH3COOH溶液可使紫色石蕊试液变红
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。
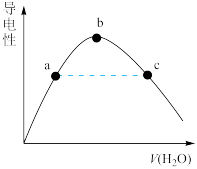
① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是______ 。
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)_____ c点溶液中的c(NH4+)。(填“<”、“>”或“=”)
| 化学式 | CH3COOH | NH3·H2O | H2CO3 | H2SO3 |
| 电离平衡常数 | 1.7×10-5 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.3×10-2 K2=6.3×10-8 |
请回答下列问题:
(1)H2CO3的第二级电离平衡常数的表达式K2=
(2)相同温度下,等pH的CH3COONa溶液、Na2CO3溶液和Na2SO3溶液,三种溶液的物质的量浓度c(CH3COONa)、c(Na2CO3)、c(Na2SO3)由大到小排序为
(3) 用足量Na2CO3溶液吸收工业尾气中少量SO2气体,发生反应的离子方程式为
(4)25℃时,向0.1 mol•L-1的氨水中缓缓少量CO2气体的过程中(忽略溶液体积的变化),下列表达式的数值变小的是
A.
C.
(5)能证明醋酸是弱酸的实验事实是
① 相同条件下,浓度均为0.1 mol•L-1的盐酸和醋酸,醋酸的导电能力更弱
② 25℃时,一定浓度的CH3COOH、CH3COONa混合溶液的pH等于7
③ CH3COOH溶液能与NaHCO3反应生成CO2
④ 0.1mol•L-1 CH3COOH溶液可使紫色石蕊试液变红
(6)向冰醋酸中逐滴加水,溶液导电性随加入水的体积变化如图所示。

① a、b、c三点溶液中CH3COOH的电离程度由大到小的顺序是
② a、c两点对应的溶液分别吸收氨气,若两溶液最终pH均为7(25℃时),则a点溶液中的c(CH3COO-)
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网