填空题 适中0.65 引用1 组卷103
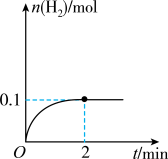
一定温度下,向1L密闭容器中加入1molHI(g),发生反应2HI(g) H2(g)+I2(g)物质的量随时间的变化如图所示。
H2(g)+I2(g)物质的量随时间的变化如图所示。
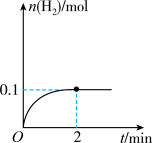
(1)0~2min内的平均反应速率v(HI)=_______ 。该温度下,H2(g)+I2(g)  2HI(g)的平衡常数K=
2HI(g)的平衡常数K=_______ 。
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_______ 是原来的2倍。
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)上述反应中,正反应速率为v正=k正·c2(HI),逆反应速率为v逆=k逆·c(H2)·c(I2)。其中k正、k逆为速率常数,则k正=_______ (以K和k逆表示)。
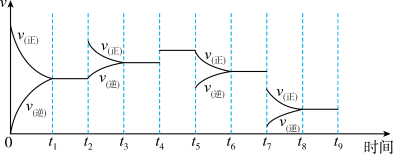
(4)氢气用于工业合成氨N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ·mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
2NH3(g);△H=-92.2kJ·mol-1,一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如图所示:
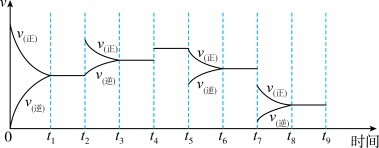
其中t5时刻所对应的实验条件改变是_______ ,平衡常数最大的时间段是_______ 。

(1)0~2min内的平均反应速率v(HI)=
(2)相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则
a.平衡常数 b.HI的平衡浓度 c.达到平衡的时间 d.平衡时H2的体积分数
(3)上述反应中,正反应速率为v正=k正·c2(HI),逆反应速率为v逆=k逆·c(H2)·c(I2)。其中k正、k逆为速率常数,则k正=
(4)氢气用于工业合成氨N2(g)+3H2(g)

其中t5时刻所对应的实验条件改变是
21-22高二上·山东临沂·阶段练习
类题推荐
合成氨是人类科学技术上的一项重大突破。工业上以天然气为原料合成氨。其生产工艺如下:造气阶段→转化阶段→分离净化→合成阶段
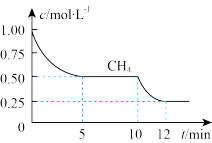
(1)造气阶段的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图所示。处于平衡的时间段为_______ 、_______ ;前5min内,用H2表示的速率为_______ ;10min时,改变的外界条件可能是_______ 。
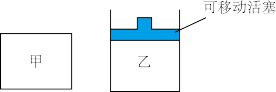
②如图所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡所需要时间:t甲_______ t乙(填“>”“<”或“=”,下同),达到平衡时两容器中CH4的转化率大小关系为:α甲(CH4)_______ α乙(CH4);
(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应中正、逆反应速率的关系式是_______ (填序号)。
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)工业合成氨的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92.4kJ·mol-1.在某压强恒定的密闭容器中加入2molN2和4molH2,达到平衡时,N2的转化率为50%,体积变为10L。求:
①该条件下的平衡常数为_______ ;
②若向该容器中加入amolN2、bmolH2、cmolNH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量_______ (填“>”“<”或“=”)92.4kJ。
(1)造气阶段的反应为:CH4(g)+H2O(g)⇌CO(g)+3H2(g) ΔH=+206.1kJ/mol
①在一密闭容器中进行上述反应,测得CH4的物质的量浓度随反应时间的变化如下图所示。处于平衡的时间段为

②如图所示,在初始容积相等的甲、乙两容器中分别充入等物质的量的CH4和H2O。在相同温度下发生反应,并维持反应过程中温度不变。则达到平衡所需要时间:t甲

(2)转化阶段发生的可逆反应为:CO(g)+H2O(g)⇌CO2(g)+H2(g),一定温度下,反应的平衡常数为K=1.某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
a.v(正)>v(逆) b.v(正)<v(逆) c.v(正)=v(逆) d.无法判断
(3)工业合成氨的热化学方程式为:N2(g)+3H2(g)⇌2NH3(g),ΔH=-92.4kJ·mol-1.在某压强恒定的密闭容器中加入2molN2和4molH2,达到平衡时,N2的转化率为50%,体积变为10L。求:
①该条件下的平衡常数为
②若向该容器中加入amolN2、bmolH2、cmolNH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 H2(g)+I2(g)物质的量随时间的变化如图所示。
H2(g)+I2(g)物质的量随时间的变化如图所示。