解答题-原理综合题 适中0.65 引用1 组卷40
Ⅰ.在氮及其化合物的化工生产中,对有关反应的反应原理进行研究有着重要意义。
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应: ,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
,测得不同温度、不同时间段内合成氨反应中N2的转化率,数据如下:
①上表中T1_______ T2(用含“>”“<”“=”的关系式表示),其中a、b、80%三者的大小关系是_______ (用含“>”“<”“=”的关系式表示)。
②研究表明,合成氨的速率与相关物质的浓度关系为 ,k为速率常数。以下说法正确的是
,k为速率常数。以下说法正确的是_______ (填字母序号)。
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡_______ (填“向左移动”“向右移动”或“不移动”)。
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为 。该过程可分为以下两步反应完成:
。该过程可分为以下两步反应完成:
甲醇合成反应:_______。
甲醇脱水反应: 。
。
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为_______ 。
(3)请写出甲醇合成反应的热化学方程式:_______ 。
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是_______ (填字母)。
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
(1)一定温度下,将2 mol N2和6 mol H2置于1 L的恒容密闭容器中发生如下反应:
| 1小时 | 2小时 | 3小时 | 4小时 | |
| T1 | 30% | 50% | 80% | 80% |
| T2 | 35% | 60% | a | b |
①上表中T1
②研究表明,合成氨的速率与相关物质的浓度关系为
A.升高温度,k值增大
B.T2℃时若容器内混合气体平均相对分子质量为12且保持不变,则反应达到平衡状态
C.一定温度下将原容器中的NH3及时分离出来可使v减小
D.合成氨达到平衡后,增大c(N2)可使正反应速率在达到新平衡的过程中始终增大
③已知某温度下该反应达平衡时各物质均为1 mol,容器容积为1 L,保持温度和压强不变,又充入3 mol N2后,平衡
Ⅱ.甲醚(CH3OCH)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为
甲醇合成反应:_______。
甲醇脱水反应:
(2)起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(3)请写出甲醇合成反应的热化学方程式:
(4)在一定条件下,将CO和H2按体积比1:2充入恒容密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是
a.混合气体的总物质的量保持不变
b.混合气体的密度保持不变
c.CH3OCH3(g)和H2O(g)的物质的量之比保持不变
d.每生成1 mol CH3OCH3(g),同时生成2 mol CO
21-22高二上·山西晋中·期中
类题推荐
Ⅰ.反应mA(g)+nB(g) pC(g) +qD(g)过程中的能量变化如图,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图,回答下列问题。
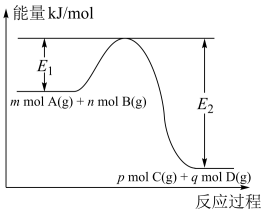
(1)该反应△H =___________ (用含E1、E2式子表示);
(2)在反应体系中加入催化剂,E1___________ (填“增大”、“减小”、“不变”),△H ___________ (填“增大”、“减小”、“不变”)。
Ⅱ.二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如下:2CO (g) +4H2 (g) CH3OCH3 (g)+ H2O (g) ΔH = -206.0 kJ/mol工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
CH3OCH3 (g)+ H2O (g) ΔH = -206.0 kJ/mol工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
①甲醇脱水反应:2CH3OH (g) CH3OCH3 (g)+ H2O (g),ΔH = -24.0 kJ/mol
CH3OCH3 (g)+ H2O (g),ΔH = -24.0 kJ/mol
②甲醇合成反应。
(3)请补全甲醇合成反应的热化学方程式:___________ 。
(4)对于该反应:2CO (g) +4H2 (g) CH3OCH3 (g)+ H2O (g) ,起始时向2L恒容容器中投入2 mol CO和4 mol H2,经过5分钟测得CH3OCH3的物质的量0.25mol,该时间段内H2的反应速率为
CH3OCH3 (g)+ H2O (g) ,起始时向2L恒容容器中投入2 mol CO和4 mol H2,经过5分钟测得CH3OCH3的物质的量0.25mol,该时间段内H2的反应速率为 ___________ 。
(5)甲醇脱水反应2CH3OH (g) CH3OCH3 (g)+ H2O (g) 在某温度下的化学平衡常数为400。此温度下,在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时反应
CH3OCH3 (g)+ H2O (g) 在某温度下的化学平衡常数为400。此温度下,在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时反应___________ (填“已达到”或“未达到”)化学平衡状态。
(6)2CH3OH (g)  CH3OCH3 (g)+ H2O (g)下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是___________(填字母)。
CH3OCH3 (g)+ H2O (g)下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是___________(填字母)。
(7)已知3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g) ΔH<0;一定条件下的密闭容器中,反应达到平衡后,要提高CO的转化率,可以采取的措施是
CH3OCH3(g) + CO2 (g) ΔH<0;一定条件下的密闭容器中,反应达到平衡后,要提高CO的转化率,可以采取的措施是___________ (填字母代号)。
a.高温高压b.加入催化剂c.减少CO2的浓度 d.增加CO的浓度 e.分离出CH3OCH3
(8)温度为T ℃时,将3a mol H2和 3a mol CO放入1L恒容密闭容器中,发生反应3H2(g) + 3CO(g) CH3OCH3(g) + CO2 (g),达到平衡时测得H2的转化率为
CH3OCH3(g) + CO2 (g),达到平衡时测得H2的转化率为 。则该反应的平衡常数为
。则该反应的平衡常数为___________ 。

(1)该反应△H =
(2)在反应体系中加入催化剂,E1
Ⅱ.二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如下:2CO (g) +4H2 (g)
①甲醇脱水反应:2CH3OH (g)
②甲醇合成反应。
(3)请补全甲醇合成反应的热化学方程式:
(4)对于该反应:2CO (g) +4H2 (g)
(5)甲醇脱水反应2CH3OH (g)
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.02 | 0.4 | 0.4 |
| A.恒温恒压下,混合气体的密度不变 |
| B.v(CH3OH)∶v(CH3OCH3)=2∶1 |
| C.在恒容绝热容器中进行时,温度保持不变 |
| D.恒温恒容下,CH3OH与CH3OCH3的物质的量之比为2:1保持不变 |
a.高温高压b.加入催化剂c.减少CO2的浓度 d.增加CO的浓度 e.分离出CH3OCH3
(8)温度为T ℃时,将3a mol H2和 3a mol CO放入1L恒容密闭容器中,发生反应3H2(g) + 3CO(g)
工业合成氨是人类科学技术的一项重大突破。其合成原理为:N2(g)+3H2(g) 2NH3(g) ΔH<0.
2NH3(g) ΔH<0.
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
(2)恒温下,往一个4 L的密闭容器中充入2 mol N2和5.2 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如表所示:
①10 min时用N2表示的平均反应速率为___________ mol·L-1·min-1.此条件下该反应的化学平衡常数K=___________ 。
②已知:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1
2NH3(g) ΔH=-92 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式___________ 。
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g) CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
CH3OCH3(g)+H2O(g) ΔH=-206.0 kJ·mol-1①。
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g) CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH=-24.0 kJ·mol-1
起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为___________ 。
(4)请写出甲醇合成反应的热化学方程式:___________ 。
(5)在一定条件下,将CO和H2按体积比1∶2充入恒容 密闭容器中,反应生成CH3OCH3(g)和H2O(g)。下列能说明该反应达到平衡状态的是___________(填字母)。
(1)在恒温恒容密闭容器中进行合成氨的反应,下列能说明该反应已达到平衡状态的___________。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.N2百分含量保持不变 |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol·L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
②已知:N2(g)+3H2(g)
N2(g)+O2(g)=2NO(g) ΔH=+181 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
写出氨气催化氧化生成NO和水蒸气的热化学方程式
(3)甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式如为2CO(g)+4H2(g)
该过程可分为以下两步反应完成:
ⅰ.甲醇合成反应:
ⅱ.甲醇脱水反应:2CH3OH(g)
起始时向容器中投入2 mol CO和4 mol H2,测得某时刻上述总反应中放出的热量为51.5 kJ,此时CO的转化率为
(4)请写出甲醇合成反应的热化学方程式:
(5)在一定条件下,将CO和H2按体积比1∶2充入
| A.混合气体的总物质的量保持不变 |
| B.混合气体的密度保持不变 |
| C.CH3OCH3(g)和H2O(g)的物质的量之比保持不变 |
| D.每生成1 mol CH3OCH3(g),同时生成2 mol CO |
二甲醚(CH3OCH3)是重要的化工原料,可用CO和H2制得,总反应的热化学方程式:

工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
①甲醇脱水反应:

②甲醇合成反应
(1)写出甲醇合成反应的热化学方程式:_______ 。
(2)对于该反应: ,起始时向2L恒容容器中投入2 mol CO和4 molH2,经过5分钟测得CH3OCH3的物质的量0.25mol,该时间段内H2的反应速率为
,起始时向2L恒容容器中投入2 mol CO和4 molH2,经过5分钟测得CH3OCH3的物质的量0.25mol,该时间段内H2的反应速率为_______ 。
(3)甲醇脱水反应 在某温度下的化学平衡常数为400。此温度下,在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时反应
在某温度下的化学平衡常数为400。此温度下,在恒容密闭容器中加入一定量的CH3OH(g),测得某时刻各组分浓度如下表所示。此时反应_______ (填“已达到”或“未达到”)化学平衡状态。
(4) 下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是_______(填字母)。
下列叙述符合事实且可作为判断反应已达到平衡状态的标志的是_______(填字母)。
(5)已知
 ;
;
一定条件下的密闭容器中,反应达到平衡后,要提高CO的转化率,可以采取的措施是_______ (填字母代号)。
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出CH3OCH3
(6)温度为T℃时,将3a molH2和3a mol CO放入1L恒容密闭容器中,发生反应 ,达到平衡时测得H2的转化率为
,达到平衡时测得H2的转化率为 。则该反应的平衡常数为
。则该反应的平衡常数为_______ 。
工业中采用“一步法”,通过复合催化剂使下列甲醇合成和甲醇脱水反应同时进行:
①甲醇脱水反应:
②甲醇合成反应
(1)写出甲醇合成反应的热化学方程式:
(2)对于该反应:
(3)甲醇脱水反应
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol/L) | 0.02 | 0.4 | 0.4 |
(4)
| A.恒温恒压下,混合气体的密度不变 |
| B. |
| C.在恒容绝热容器中进行时,温度保持不变 |
| D.恒温恒容下,CH3OH与CH3OCH3的物质的量之比为2:1保持不变 |
一定条件下的密闭容器中,反应达到平衡后,要提高CO的转化率,可以采取的措施是
a.高温高压 b.加入催化剂 c.减少CO2的浓度 d.增加CO的浓度 e.分离出CH3OCH3
(6)温度为T℃时,将3a molH2和3a mol CO放入1L恒容密闭容器中,发生反应
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


