解答题-原理综合题 适中0.65 引用1 组卷53
二氧化碳捕获技术用于去除气流中的二氧化碳或者分离出二氧化碳作为气体产物,其中CO2催化合成甲醇是一种很有前景的方法。如下图所示为该反应在无催化剂及有催化剂时的能量变化。
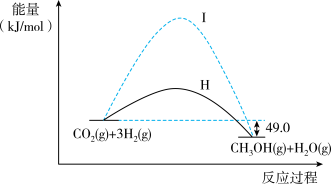
(1)从图可知,有催化剂存在的是过程_________ (填“Ⅰ”或“Ⅱ”)。
(2)写出图中CO2催化合成甲醇的热化学方程式:_________ 。
(3)若要提高反应速率,可以采取的措施有_________ 。
(4)若要提高上述可逆反应 中甲醇的平衡产率,可以采取的措施有_________ 。
(5)已知:1 mol液态甲醇完全气化需吸热37.4 kJ,1 mol液态水完全气化需吸热44.0 kJ,由CO2合成1 mol液态甲醇和1 mol液态水将_________ (填“吸收”或“放出”)_________ kJ热量。
(6)关于CO2催化合成甲醇的反应,下列说法中,合理的是_________ (填字母序号)。
a.该反应中所有原子都被用于合成甲醇
b.该反应可用于CO2的转化,有助于缓解温室效应
c.使用催化剂可以降低该反应的ΔH,从而使反应放出更多热量
d.降温分离出液态甲醇和水,将剩余气体重新通入反应器,可以提高CO2与H2的利用率

(1)从图可知,有催化剂存在的是过程
(2)写出图中CO2催化合成甲醇的热化学方程式:
(3)若要提高反应速率,可以采取的措施有
(4)若要提高上述
(5)已知:1 mol液态甲醇完全气化需吸热37.4 kJ,1 mol液态水完全气化需吸热44.0 kJ,由CO2合成1 mol液态甲醇和1 mol液态水将
(6)关于CO2催化合成甲醇的反应,下列说法中,合理的是
a.该反应中所有原子都被用于合成甲醇
b.该反应可用于CO2的转化,有助于缓解温室效应
c.使用催化剂可以降低该反应的ΔH,从而使反应放出更多热量
d.降温分离出液态甲醇和水,将剩余气体重新通入反应器,可以提高CO2与H2的利用率
21-22高二上·北京西城·阶段练习
类题推荐  捕获技术用于去除气流中的
捕获技术用于去除气流中的 或者分离出
或者分离出 作为气体产物,其中
作为气体产物,其中 催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
催化合成甲醇是一种很有前景的方法。如图所示为该反应在无催化剂及有正催化剂时的能量变化(该反应为可逆反应)。
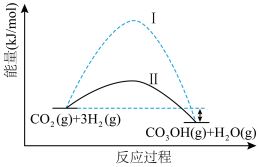
(1)温度为523 K时,测得上述反应中生成 放出的热量为12.3 kJ。反应的热化学方程式为
放出的热量为12.3 kJ。反应的热化学方程式为___________ 。
(2)从图可知,有催化剂存在的是过程___________ (填“Ⅰ”或“Ⅱ”)。
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入 和
和 ,加入合适催化剂进行反应。某时刻测得
,加入合适催化剂进行反应。某时刻测得 ,此时反应
,此时反应___________ (填“正向移动”、“逆向移动”或“达到平衡)。已知该温度下反应的化学平衡常数值为1/40.
(4)关于 催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
催化合成甲醇的反应,下列说法中合理的是___________(填字母序号)。
(5)制备过程中存在副反应:
 将混合气按进料比
将混合气按进料比 通入反应装置,选择合适催化剂发生反应。不同温度和压强下,
通入反应装置,选择合适催化剂发生反应。不同温度和压强下, 平衡产率和
平衡产率和 平衡转化率分别如图1、图2。
平衡转化率分别如图1、图2。
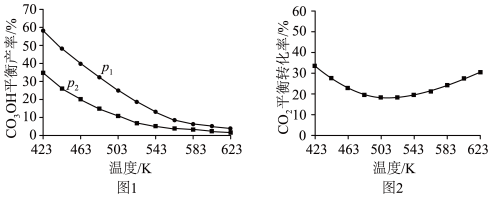
①图1中,压强
___________  (填“>”“=”或“<”),推断的依据是
(填“>”“=”或“<”),推断的依据是___________ 。
②图2中,压强为 ,温度高于503 K后,
,温度高于503 K后, 平衡转化率随温度升高而增大的原因是
平衡转化率随温度升高而增大的原因是___________ 。
甲醇是重要的化工原料,应用前景广阔。其中CO2催化合成甲醇是一种很有前景的方法。下图为该反应在无催化剂及有催化剂时的能量变化。
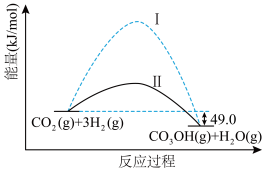
(1)从图上可看出,有催化剂存在的过程是___________ (填“I”或“II”)。
(2)写出图中CO2催化合成甲醇的热化学方程式:___________ 。
(3)已知:1 mol液态甲醇完全气化需吸热37.4 kJ,1 mol液态水完全气化需吸热44.0 kJ,若产物为1 mol液态甲醇和1 mol液态水,将会多___________ (填“吸收”或“放出”)___________ kJ热量。
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是___________(填字母序号)。
(5)研究温度对甲醇产率的影响时发现,在210~290℃,保持原料气中CO2和H2的投料比不变,得到平衡时甲醇的产率与温度的关系如下图所示,
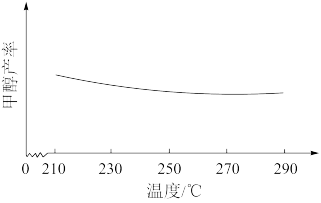
则该反应的ΔH___________ 0(填“>”、“<”或“=”),依据是___________ 。

(1)从图上可看出,有催化剂存在的过程是
(2)写出图中CO2催化合成甲醇的热化学方程式:
(3)已知:1 mol液态甲醇完全气化需吸热37.4 kJ,1 mol液态水完全气化需吸热44.0 kJ,若产物为1 mol液态甲醇和1 mol液态水,将会多
(4)关于CO2催化合成甲醇的反应,下列说法中,合理的是___________(填字母序号)。
| A.该反应中所有原子都被用于合成甲醇 |
| B.该反应可用于CO2的转化,有助于缓解温室效应 |
| C.使用催化剂可以降低该反应的ΔH,从而使反应放出更多热量 |
| D.降温分离出液态甲醇和水,将剩余气体重新通入反应器,可以提高CO2与H2的利用率 |

则该反应的ΔH

(1)温度为523 K时,测得上述反应中生成
(2)从图可知,有催化剂存在的是过程
(3)一定温度下(各物质均为气态),向体积为2 L的恒容密闭容器中充入
(4)关于
| A.该反应原子转化率为100% |
| B.该反应可用于 |
| C.使用催化剂可以降低该反应的 |
| D.降温分离液态甲醇和水,将剩余气体重新通入反应器,可提高 |

①图1中,压强
②图2中,压强为
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g) CH3OH(g)
CH3OH(g)
(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
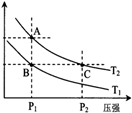
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
 CH3OH(g)
CH3OH(g)(1)判断反应达到平衡状态的依据是 (填序号)。
a.生成CH3OH的速率与消耗CO的速率相等
b.混合气体的密度不变
c.混合气体的平均相对分子质量不变
d.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是该反应在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
①该反应的平衡常数表达式K= ,△H 0(填“>”、“<”或“=”)。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温 b.加入催化剂 c.增加CO的浓度
d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(3)右图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用____________的方法(填“升温”或“降温”)。

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-a kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH =-b kJ·mol-1 ③H2O(g)= H2O(l) ΔH=-c kJ·mol-1
写出1摩尔液态CH3OH不完全燃烧生成一氧化碳和液态水的热化学方程式_________________。
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


