解答题-实验探究题 适中0.65 引用1 组卷63
碳酸钠和碳酸氢钠是中学化学常见的化合物,某化学兴趣小组对碳酸钠和碳酸氢钠与稀盐酸的反应进行了如下实验:
Ⅰ:验证 和
和 分别与稀盐酸反应的快慢
分别与稀盐酸反应的快慢
向2支具支试管中分别加入0.1 g碳酸钠和0.08 g碳酸氢钠粉末,2支注射器中各抽取5 mL 1 稀盐酸,如图所示,用注射器同压板同时按下注射器活塞,注入稀盐酸,观察现象。
稀盐酸,如图所示,用注射器同压板同时按下注射器活塞,注入稀盐酸,观察现象。
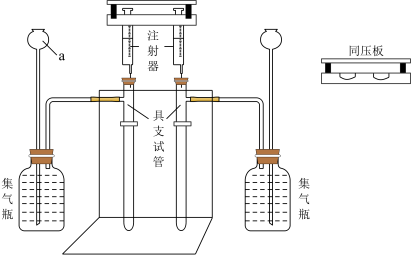
(1)仪器a的名称是_______ 。
(2)加入试剂前需_______ 。
(3)集气瓶中的试剂最优选择是_______ (填标号),使用同压板的优点有_______ (填一条即可)。
A.滴有红墨水的水
B.滴有红墨水的饱和碳酸钠溶液
C.滴有红墨水的饱和碳酸氢钠溶液
(4)为验证 和
和 分别与稀盐酸反应的快慢,需测量的数据是
分别与稀盐酸反应的快慢,需测量的数据是_______ 。
Ⅱ:探究 和
和 与稀盐酸反应的热效应(实验中所用盐酸浓度均为1.0
与稀盐酸反应的热效应(实验中所用盐酸浓度均为1.0  )
)
实验一:向试剂1中加入试剂2,搅拌、测温,记录结果如表所示。
实验二:向试剂3中加入试剂4,搅拌、测温,静置、测温,再加入试剂5,搅拌、测温,记录结果如表所示。
(5)通过实验一的数据计算:(可近似地认为实验中所用溶液的密度、比热容与水的相同,并忽略容器的比热容,水的比热容为 )
)
①

_______ (保留四位有效数字,下同) 。
。
②

_______  。
。
(6)分析实验二可知, 溶于水是
溶于水是_______ (填“放热”或“吸热”,下同)过程, 与稀盐酸的反应是
与稀盐酸的反应是_______ 反应。
(7)该小组同学通过查阅资料发现,实验中测得的 、
、 均偏小,排除实验中的误差,出现该结果的原因可能是
均偏小,排除实验中的误差,出现该结果的原因可能是_______ 。
Ⅰ:验证
向2支具支试管中分别加入0.1 g碳酸钠和0.08 g碳酸氢钠粉末,2支注射器中各抽取5 mL 1

(1)仪器a的名称是
(2)加入试剂前需
(3)集气瓶中的试剂最优选择是
A.滴有红墨水的水
B.滴有红墨水的饱和碳酸钠溶液
C.滴有红墨水的饱和碳酸氢钠溶液
(4)为验证
Ⅱ:探究
实验一:向试剂1中加入试剂2,搅拌、测温,记录结果如表所示。
| 试剂1 | 试剂2混合前的温度/℃ | 混合后最高或最低温度/℃ |
| 1.0 g | 20 mL HCl 22.0 | 25.5 |
| 1.0 g | 20 mL HCl 22.0 | 19.4 |
| 试剂3 | 试剂4温度/C | 溶解后温度/℃ | 静置后温度/℃ | 试剂5温度/℃ | 混合后温度/c |
| 1.0 g | 20 mL | 23.8 | 22.0 | 20 mL HCl 22.0 | 23.5 |
| 1.0 g | 20 mL | 19.5 | 22.0 | 20 mL HCl 22.0 | 21.4 |
①
②
(6)分析实验二可知,
(7)该小组同学通过查阅资料发现,实验中测得的
22-23高二上·云南·阶段练习
类题推荐
A.为探究碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应,某化学兴趣小组进行如下实验。
查阅资料:反应Ⅰ:
 ;
;
反应Ⅱ:

(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为___________ 。
(2)向 碳酸钠溶液中,逐滴加入
碳酸钠溶液中,逐滴加入 稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是___________(填标号)。
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
表格2:
表格3:
(3)表格1实验___________ (填“能”或“否”)验证
 ,
,
 。
。
(4)实验中玻璃搅拌器的使用方法是___________ 。(填标号)
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是___________ 。
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ:
 ;
;
反应Ⅴ:

则
___________  (填“>”、“<”或“=”,下同),
(填“>”、“<”或“=”,下同),
___________  。
。
查阅资料:反应Ⅰ:
反应Ⅱ:
(1)反应Ⅲ:向碳酸钠溶液中滴加少量盐酸生成碳酸氢钠的离子反应的热化学方程式为
(2)向
A.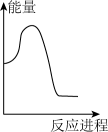 | B.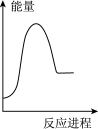 | C.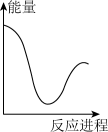 | D.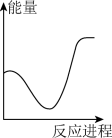 |
B.实验探究:按表格所示用量,在量热器中将相应试剂混合后测定温度,验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格1:
| 试剂1 | 试剂2 | 试剂1和试剂2混合后温度 |
| 19.0℃的40 mL HCl | 21.7℃ | |
| 19.0℃的40 mL HCl | 18.1℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
| 19.0℃的 | 22.3℃ | 19.0℃ | 19.0℃的10 mL HCl | 20.5℃ | |
| 19.0℃的 | 17.5℃ | 19.0℃ | 19.0℃的10 mL HCl | 18.3℃ |
| 试剂1 | 试剂2 | 试剂1溶解于试剂2后的温度 | 静置后混合液的温度 | 试剂3 | 静置后混合液再加入试剂3后的温度 |
| 19.0℃的 | 22.3℃ | 19.0℃ | 19.0℃的 | 19.0℃ | |
| 19.0℃的 | 17.5℃ | 19.0℃ | 19.0℃的 | 19.0℃ |
(3)表格1实验
(4)实验中玻璃搅拌器的使用方法是
A.顺时针搅拌 B.逆时针搅拌 C.上下拉动
(5)进行表格3操作的目的是
(6)结合实验探究所得的结论进行分析判断。
反应Ⅳ:
反应Ⅴ:
则
某化学兴趣小组进行了实验:向2支试管中分别加入0.5 g Na2CO3固体和0.5 g NaHCO3固体,再分别加入30 mL0.3 mol·L-1盐酸,充分反应后,用手触摸试管,明显感觉到加Na2CO3固体的试管变热了,加NaHCO3固体的试管变冷了。甲同学由此得出结论: (aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0,
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1<0, (aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:
(aq)+H+ (aq) =H2O(l) +CO2(g) △H2>0。回答下列问题:
(1)乙同学认为该实验不一定能得到甲同学的结论,因为碳酸钠或碳酸氢钠固体溶于水时会有能量变化,乙同学的观点_______ (填“合理”或“不合理”)。
(2)查阅资料:
反应I: (aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1
(aq)+2H+(aq)=H2O(l)+CO2(g) △H1=-12.14kJ· mol-1
反应II: (aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1
(aq)+H+(aq)=H2O(l) +CO2(g) △H2 +12.64 kJ·mol-1
反应III: (aq)+ H+ (aq)=
(aq)+ H+ (aq)= (aq) △H3=
(aq) △H3=_______ kJ·mol-1
②向VmLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是_______ (填标号)。
A.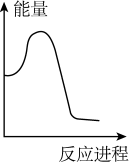 B.
B.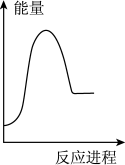 C.
C.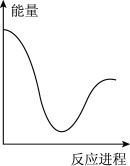 D.
D.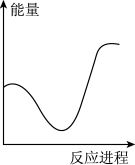
(3)该化学兴趣小组用如图所示装置设计实验验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。
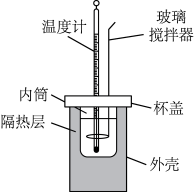
表格一:
表格二:
表格三:
实验操作:将试剂1与试剂2混合,测混合后溶液的温度,静置,冷却至定温,再将试剂3与之前的。混合溶液混合,再测混合溶液的温度。
①实验中玻璃搅拌器的使用方法是_______ (填 “顺时针搅动”“逆时针搅动”或“上下移动”)。
②表格二对应实验得出的结论是_______ 。
③反应IV:Na2CO3(s)+2H+(aq)= 2Na+(aq)+H2O(l)+CO2(g) △H4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(1)+CO2(g) △H5
则△H1_______ △H4(填“>”“ <”或“=”,下同),△H2_______ △H5。
(1)乙同学认为该实验不一定能得到甲同学的结论,因为碳酸钠或碳酸氢钠固体溶于水时会有能量变化,乙同学的观点
(2)查阅资料:
反应I:
反应II:
反应III:
②向VmLc mol·L-1碳酸钠溶液中,逐滴加入2V mL c mol·L-1稀盐酸。下列图象中,能正确表示该反应过程中的能量变化的是
A.
 B.
B. C.
C. D.
D.
(3)该化学兴趣小组用如图所示装置设计实验验证碳酸钠、碳酸氢钠分别与稀盐酸反应的热效应。

表格一:
| 试剂1 | 试剂2混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 40mL HCl 19.0 | 21.7 |
| 0.5 g NaHCO3 | 40 mL HCl 19.0 | 18.1 |
| 试剂1 | 试剂2混合前温度/℃ | 溶解后温度/℃ | 静置后的温度/℃ | 试剂3混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLH2O19.0 | 19.0 |
| 0.5 g NaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLH2O19.0 | 19.0 |
| 试剂1 | 试剂2混合温度/℃ | 溶解后温度/℃ | 静置后的温度/℃ | 试剂3混合前温度/℃ | 混合后温度/℃ |
| 0.5 g Na2CO3 | 10mLH2O19.0 | 22.3 | 19.0 | 10mLHCl19.0 | 20.5 |
| 0.5 g NaHCO3 | 10mLH2O19.0 | 17.5 | 19.0 | 10mLHCl19.0 | 18.3 |
①实验中玻璃搅拌器的使用方法是
②表格二对应实验得出的结论是
③反应IV:Na2CO3(s)+2H+(aq)= 2Na+(aq)+H2O(l)+CO2(g) △H4;
反应V:NaHCO3(s)+H+(aq)=Na+(aq)+H2O(1)+CO2(g) △H5
则△H1
某化学兴趣小组计划测定一久置盐酸的浓度,并用改进的装置进行酸碱中和反应反应热的测定实验。其实验过程如下:
Ⅰ.稀盐酸浓度的测定
①用酸式滴定管量取25.00mL该盐酸样品,配成250mL一定浓度的待测稀盐酸;
②用酸式滴定管移取20.00mL待测稀盐酸于锥形瓶中,加入2~3滴酚酞作指示剂;
③用碱式滴定管盛装 标准溶液,排气泡,静置,读取数据,记录为NaOH标准溶液的初始读数;
标准溶液,排气泡,静置,读取数据,记录为NaOH标准溶液的初始读数;
④滴定,并记录NaOH标准溶液的终点读数。重复滴定几次,数据记录如表:
(1)下列仪器在使用前需要润洗的是__________(填标号)。
(2)第3次滴定终点时碱式滴定管液面如图所示,则
__________ 。

(3)滴定终点的现象为__________ 。
(4)该盐酸样品的浓度为__________  。
。
Ⅱ.强酸与强碱的稀溶液发生中和反应的反应热的测定
(5)如图实验装置图中缺少的用于搅拌的玻璃仪器的名称为__________ ,如果用铜制仪器代替该玻璃仪器进行实验,测得的中和反应的反应热( )
)__________ (填“偏高”“偏低”或“无影响”)。
(6)同学们先在塑料瓶中加入25.00mLI中配制的稀盐酸,然后通过注射器注入 溶液,溶液恰好完全反应时,混合溶液平均温度由
溶液,溶液恰好完全反应时,混合溶液平均温度由 ℃(初始)升到
℃(初始)升到 ℃(最高),生成
℃(最高),生成 时的反应热(
时的反应热( )为
)为__________  (只列计算式,已知溶液密度近似为
(只列计算式,已知溶液密度近似为 ,比热容为
,比热容为 )
)

Ⅰ.稀盐酸浓度的测定
①用酸式滴定管量取25.00mL该盐酸样品,配成250mL一定浓度的待测稀盐酸;
②用酸式滴定管移取20.00mL待测稀盐酸于锥形瓶中,加入2~3滴酚酞作指示剂;
③用碱式滴定管盛装
④滴定,并记录NaOH标准溶液的终点读数。重复滴定几次,数据记录如表:
滴定次数 实验数据 | 1 | 2 | 3 | 4 |
NaOH标准溶液初始读数/mL | 0.28 | 0.30 | 2.50 | 0.22 |
NaOH标准溶液终点读数/mL | 22.28 | 22.28 | a | 22.24 |
NaOH标准溶液消耗/mL |
| A.容量瓶 | B.锥形瓶 | C.碱式滴定管 | D.酸式滴定管 |

(3)滴定终点的现象为
(4)该盐酸样品的浓度为
Ⅱ.强酸与强碱的稀溶液发生中和反应的反应热的测定
(5)如图实验装置图中缺少的用于搅拌的玻璃仪器的名称为
(6)同学们先在塑料瓶中加入25.00mLI中配制的稀盐酸,然后通过注射器注入

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


