解答题-工业流程题 较难0.4 引用2 组卷650
工业上用红土镍矿(主要成分为NiO,含 CoO、FeO、Fe2O3、Al2O3、MgO、CaO和SiO2)制备 NiSO4·6H2O。工艺流程如下所示。

已知:溶液中金属离子开始沉淀和完全沉淀的pH:
(1)加入H2SO4在高压下进行酸浸。充分浸取后过滤出的酸浸渣的主要成分为_______ (填化学式)。
(2)氧化、沉铁沉铝时,加入 NaClO 和 Na2CO3溶液共同作用。其中与FeSO4发生氧化还原反应的离子方程式为_______ 。
(3)沉镁沉钙加入NaF溶液,生成MgF2和CaF2.若沉淀前溶液中c(Ca2+)=1.0×10-3 mol·L-1,当沉淀完全后滤液中c(Mg2+)=1.5×10-6mol·L-1时,除钙率为_______ (忽略沉淀前后溶液体积变化)。(已知:Ksp(CaF2)=1.5×10-10、Ksp(MgF2)=7.5×10-11)
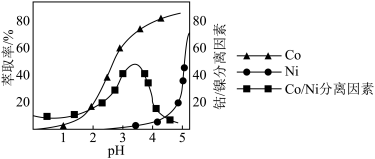
(4)“萃取”可将金属离子进行富集与分离,原理如下:M2+(水相)+2RH (有机相) MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:
MR2(有机相)+2H+(水相)。工业上用25%P5O7+5%TBP+70%磺化煤油做萃取剂,萃取时, Co、Ni的浸出率和 Co/Ni分离因素随pH的关系如图所示:

①萃取时,选择pH为_______ 左右。
②反萃取的试剂为_______ 。
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
由 NiSO4溶液获得稳定的NiSO4·6H2O 晶体的操作依次是蒸发浓缩、_______ 、过滤、洗涤、干燥。

已知:溶液中金属离子开始沉淀和完全沉淀的pH:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ | Co2+ | Mg2+ |
| 开始沉淀时的pH | 6.8 | 4.1 | 2.2 | 7.5 | 7.2 | 9.4 |
| 沉淀完全时的pH | 9.2 | 5.4 | 3.2 | 9.0 | 9.0 | 12.4 |
(2)氧化、沉铁沉铝时,加入 NaClO 和 Na2CO3溶液共同作用。其中与FeSO4发生氧化还原反应的离子方程式为
(3)沉镁沉钙加入NaF溶液,生成MgF2和CaF2.若沉淀前溶液中c(Ca2+)=1.0×10-3 mol·L-1,当沉淀完全后滤液中c(Mg2+)=1.5×10-6mol·L-1时,除钙率为
(4)“萃取”可将金属离子进行富集与分离,原理如下:M2+(水相)+2RH (有机相)

①萃取时,选择pH为
②反萃取的试剂为
(5)资料显示,硫酸镍结晶水合物的形态与温度有如下关系。
| 温度 | 低于30.8℃ | 30.8℃~53.8℃ | 53.8℃~280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
2022·江苏泰州·模拟预测
类题推荐
主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,从该矿渣中回收六水合硫酸镍晶体的工艺流程如图:

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)28Ni位于元素周期表_____ 区(填“s”“p”“d”或“ds”),其基态原子核外电子的空间运动状态有_____ 种。
(2)“焙烧”中,SiO2几乎不发生反应,NiO、CaO、FeO转化为相应的硫酸盐。NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为______ 。
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有______ (填化学式),为检验浸出液中是否含有Fe3+,可选用的化学试剂是______ 。
(4)“浸出液”中c(Ca2+)=1.0×10-3mol•L-1,加NaF固体时,忽略溶液体积变化,当除钙率达到99%时,除钙后的溶液中c(F-)=______ 。[已知Ksp(CaF2)=4.0×10-11]
(5)“萃取”时发生反应Mn+(水相)+nRH(有机相) MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与
MRn(有机相)+nH+(水相)(Mn+为金属离子,RH为萃取剂),萃取率与 的关系如图所示,V0/VA的最佳取值为
的关系如图所示,V0/VA的最佳取值为______ ;“反萃取”能使有机相再生而循环使用,可在有机相中加入______ ,待充分反应后再分液。

(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
从NiSO4溶液获得稳定的NiSO4•H2O晶体的操作是:______ 、______ 、过滤、洗涤、干燥等多步操作。

已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。
(1)28Ni位于元素周期表
(2)“焙烧”中,SiO2几乎不发生反应,NiO、CaO、FeO转化为相应的硫酸盐。NiFe2O4生成NiSO4、Fe2(SO4)3,发生该反应的化学方程式为
(3)“浸渣”的成分除Fe2O3、FeO(OH)外还含有
(4)“浸出液”中c(Ca2+)=1.0×10-3mol•L-1,加NaF固体时,忽略溶液体积变化,当除钙率达到99%时,除钙后的溶液中c(F-)=
(5)“萃取”时发生反应Mn+(水相)+nRH(有机相)

(6)资料显示,硫酸镍结晶水合物的形态与温度有如表关系:
| 温度 | 低于30.8℃ | 30.8~53.8℃ | 53.8~280℃ | 高于280℃ |
| 晶体形态 | NiSO4•7H2O | NiSO4•H2O | 多种结晶水合物 | NiSO4 |
三氧化二镍(Ni2O3)经常用于制造镍氢电池,也可用于镍粉的制造,工业上利用含镍废料(主要成分为镍、铝、铁及其氧化物、碳等)回收其中的镍并制备Ni2O3的工艺流程如下所示:

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
③反萃取的反应原理为NiR2+2H+ Ni2++2HR
Ni2++2HR
(1)“预处理”操作目的是除去镍废料表面的矿物油污,可选用试剂为___________ (填标号)。
A. 酒精 B.纯碱溶液 C.NaOH溶液
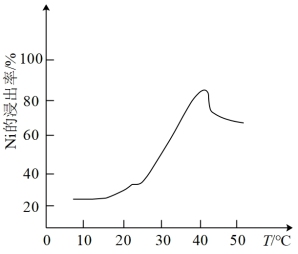
(2)酸浸时镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是___________ (从两个角度分析)。
(3)“氧化”时主要反应的离子方程式是___________ 。
(4)利用上述表格数据,可计算出Fe(OH)3的Ksp=___________ (用科学记数法表示,已知lg2=0.3),若“氧化”后的溶液中Ni2+浓度为0.1 mol/L,则“调pH”应控制的pH范围是___________ 。
(5)向有机相中加入 溶液能进行反萃取的原因为
溶液能进行反萃取的原因为___________ (用化学平衡移动原理解释)。
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
从NiSO4溶液获得稳定的NiSO4·6H2O晶体的操作依次是___________ 。
(7)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为___________ 。

已知:①NiCl2易溶于水,在该实验条件下H2O2、Fe3+不能氧化Ni2+
②溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.010mol/L)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 完全沉淀时(c=1.0×10-5mol/L)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(1)“预处理”操作目的是除去镍废料表面的矿物油污,可选用试剂为
A. 酒精 B.纯碱溶液 C.NaOH溶液
(2)酸浸时镍的浸出率与温度的关系如图所示,温度高于40℃时镍的浸出率开始下降,主要原因可能是

(3)“氧化”时主要反应的离子方程式是
(4)利用上述表格数据,可计算出Fe(OH)3的Ksp=
(5)向有机相中加入
(6)资料显示,硫酸镍结晶水合物的形态与温度有如下关系:
| 温度 | 低于30.8℃ | 30.8℃-53.8℃ | 53.8℃-280℃ | 高于280℃ |
| 晶体形态 | NiSO4·7H2O | NiSO4·6H2O | 多种结晶水合物 | NiSO4 |
(7)有机相提取的Ni2+再生时可用于制备镍氢电池(碱性),该电池充电时的总反应为Ni(OH)2+M=NiOOH+MH,则放电时负极的电极反应式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网