单选题 较难0.4 引用1 组卷238
中科院设计并完成了 催化氧化
催化氧化 制取
制取 的新路径,其主要反应为:
的新路径,其主要反应为:
反应I:

反应II:

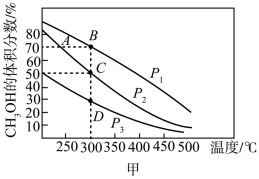
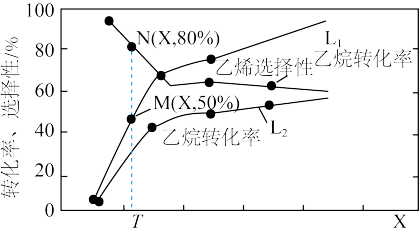
一定条件下,向容积为0.5L的容器中通入2.5mol 和5mol
和5mol ,若仅考虑上述反应,
,若仅考虑上述反应, 平衡转化率和平衡时
平衡转化率和平衡时 的选择性随温度、压强的关系如图所示,
的选择性随温度、压强的关系如图所示, 、
、 代表不同压强下乙烷的平衡转化率。
代表不同压强下乙烷的平衡转化率。
已知: 的选择性
的选择性
下列说法正确的是
反应I:
反应II:
一定条件下,向容积为0.5L的容器中通入2.5mol
已知:

下列说法正确的是
| A.压强 |
| B.压强为 |
| C.压强为 |
| D.一定温度下,增大 |
22-23高三上·湖南长沙·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网