解答题-原理综合题 适中0.65 引用1 组卷52
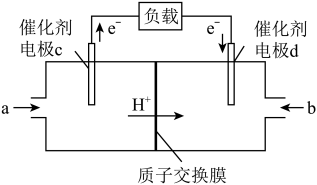
Ⅰ、
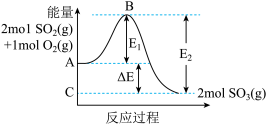
(1)已知:



则CO与NO反应生成 气体和
气体和 气体的热化学方程式为
气体的热化学方程式为___________ 。
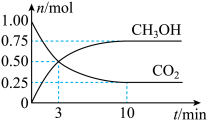
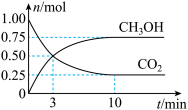
Ⅱ、一定温度下,在体积为2L的密闭容器中,充入1mol 和3mol
和3mol 发生如下反应:
发生如下反应:
 。经测得
。经测得 和
和 (g)的物质的量随时间变化如图所示。
(g)的物质的量随时间变化如图所示。
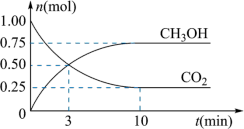
(2)从反应开始到平衡,需要的时间___________ ,在这段时间内, 的平均反应速率
的平均反应速率
___________ 。
(3)达到平衡时, 的转化率为
的转化率为___________ (用百分数表示);此温度下该反应的平衡常数K=___________ (可用分数表示)。
(4)下列措施不能提高反应速率的是___________。
(5)下列叙述中不能说明上述反应达到平衡状态的是___________ 。
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C. 在混合气体中的质量分数保持不变
在混合气体中的质量分数保持不变
D.反应中 与
与 的物质的量之比为1∶1
的物质的量之比为1∶1
E.单位时间内每消耗1mol 同时生成1mo
同时生成1mo
(1)已知:
则CO与NO反应生成
Ⅱ、一定温度下,在体积为2L的密闭容器中,充入1mol

(2)从反应开始到平衡,需要的时间
(3)达到平衡时,
(4)下列措施不能提高反应速率的是___________。
| A.升高温度 | B.加入适当催化剂 |
| C.缩小体积,增大压强 | D.恒温、恒压下通入氦气 |
A.混合气体的平均相对分子质量保持不变
B.混合气体的压强不随时间的变化而变化
C.
D.反应中
E.单位时间内每消耗1mol
22-23高二上·广东茂名·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。
2Ni(OH)2+Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸。