解答题-原理综合题 适中0.65 引用1 组卷72
回答下列问题:
(1)常温下,将pH和体积均相同的H2SO4和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如如图:

①曲线Ⅰ代表_______ 溶液(填“H2SO4”或“CH3COOH”)。
②a、b两点对应的溶液中,水的电离程度a_______ b(填“>”、“<”或“=”)。
③向上述H2SO4溶液和CH3COOH溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为V1 和V2,则V1_______ V2(填“>”、“<”或“=”)。
(2)某温度下,测得0.01mol·L-1的NaOH溶液的pH=11。
①该温度下,纯水的Kw=_______ 。
②将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,所得混合液为中性。则Va︰Vb=_______ 。
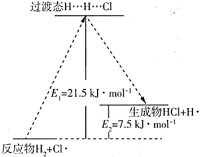
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。该基元反应逆反应的活化能为_______ kJ·mol-1
(4)键能可用于估算反应的ΔH。已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
则表中a为_______ 。
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的热化学方程式为_______ 。
(1)常温下,将pH和体积均相同的H2SO4和CH3COOH溶液分别稀释,溶液pH随加水体积的变化如如图:

①曲线Ⅰ代表
②a、b两点对应的溶液中,水的电离程度a
③向上述H2SO4溶液和CH3COOH溶液分别滴加等浓度的NaOH溶液,当恰好中和时,消耗NaOH溶液体积分别为V1 和V2,则V1
(2)某温度下,测得0.01mol·L-1的NaOH溶液的pH=11。
①该温度下,纯水的Kw=
②将pH=12的NaOH溶液Va L与pH=2的H2SO4溶液Vb L混合,所得混合液为中性。则Va︰Vb=
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。该基元反应逆反应的活化能为

(4)键能可用于估算反应的ΔH。已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其它相关数据如下表:
| H2(g) | Br2(g) | HBr(g) | |
| 1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | a | 369 |
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的热化学方程式为
22-23高二上·福建泉州·阶段练习
类题推荐
二氧化硫、氯气、氧化亚砜均为重要的工业原料。工业上用SO2、SCl2与Cl2反应合成氯化亚砜:SO2(g)+Cl2(g)+SCl2(g) 2SOCl2(g)
2SOCl2(g)
(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据Ⅰ(反应达到平衡时的温度与起始温度相同,P0为初始压强)。
谪回答下列问题:
①该反应的△H_________ (填“>”“ <”或“=”)0。
②若只改变某一条件,其他条件相同时.测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是_________ 。
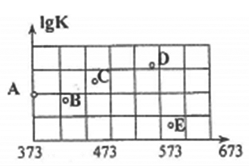
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
①A点的数值为______________ 。(已知:lg4=0.6)
②当升高到某一温度时.反应重新达到平衡,A点可能变化为___________ 点。
(3)已知反应 S4(g)+4Cl2(g) = 4SCl2(g)的△H=-4kJ·mol-1,1molS4(g)、lmolSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为__________ kJ。
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2Ka2=1.02×10-7。
①SOCl2溶于水中可形成两种酸,其中HCl的物质的量浓度为10mol/L时,H2SO3的物质的量浓
度_______ (大于、小于、等于)1.25mol/L。
②向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=amL时,溶液中离子浓度有如下关系:c (Na+) =2c (SO32-) +c (HSO3-) ;当V=bmL时,溶液中离子浓度有如下关系:c (Na+) =c(SO32-) +c (HSO3-) +c(H2SO3);则 a________ b(大于、小于、等于)。
 2SOCl2(g)
2SOCl2(g)(1)在373K时,向10L的密闭容器中通入SO2、SCl2与Cl2均为0.20mol,发生上述反应。测得其压强(p)随时间(t)的变化为表中数据Ⅰ(反应达到平衡时的温度与起始温度相同,P0为初始压强)。
| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| Ⅰ | P | 6.0 P0 | 6.7 P0 | 6.l P0 | 5.4 P0 | 5.0 P0 | 5.0 P0 |
| II | P | 6.0 P0 | 7.0 P0 | 5.3 P0 | 5.O P0 | 5.0 P0 | 5.0 P0 |
谪回答下列问题:
①该反应的△H
②若只改变某一条件,其他条件相同时.测得其压强随时间的变化为表中数据Ⅱ,则改变的条件是
(2)如图是某同学测定上述反应的平衡常数的对数值(lgK)与温度的变化关系点。
①A点的数值为
②当升高到某一温度时.反应重新达到平衡,A点可能变化为
(3)已知反应 S4(g)+4Cl2(g) = 4SCl2(g)的△H=-4kJ·mol-1,1molS4(g)、lmolSCl2(g)分子中化学键断裂时分别需要吸收1064kJ、510kJ的能量,则1molCl2(g)分子中化学键断裂时需吸收的能量为
(4)常温下饱和亚硫酸溶液的物质的量浓度为1.25mol/L,电离常数为Ka1=1.54×10-2Ka2=1.02×10-7。
①SOCl2溶于水中可形成两种酸,其中HCl的物质的量浓度为10mol/L时,H2SO3的物质的量浓
度
②向10mL饱和H2SO3溶液中滴加相同物质的量浓度的NaOH溶液VmL,当V=amL时,溶液中离子浓度有如下关系:c (Na+) =2c (SO32-) +c (HSO3-) ;当V=bmL时,溶液中离子浓度有如下关系:c (Na+) =c(SO32-) +c (HSO3-) +c(H2SO3);则 a
回答问题:
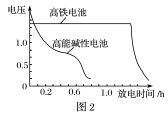
(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。
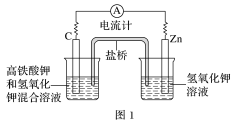
①该电池放电时正极反应式为___________ 。
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向___________ (填“左”或“右”)移动;
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________ 。
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。
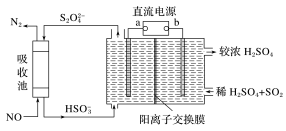
①a是直流电源的___________ 极。
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为___________ 。
③用离子方程式表示吸收NO的原理___________ 。
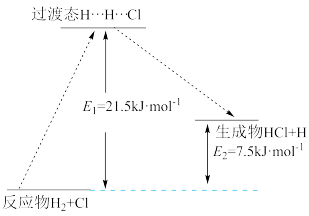
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。

该基元反应的活化能为___________ kJ·mol-1,ΔH为___________ kJ·mol-1。
(4)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
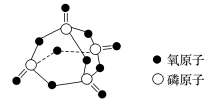
已知白磷的标准燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=___________ 。
(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为___________ 。
(1)高铁酸钾(K2FeO4)不仅是一种理想的水处理剂,而且高铁电池的研制也在进行中。如图1所示是高铁电池的模拟实验装置。


①该电池放电时正极反应式为
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有
(2)SO2和NOx是主要大气污染物,利用如图装置可同时吸收SO2和NO。

①a是直流电源的
②已知电解池的阴极室中溶液的pH在4~7之间,阴极的电极反应为
③用离子方程式表示吸收NO的原理
(3)一定温度下,反应H2+Cl2=2HCl中的某一基元反应为H2+Cl=HCl+H,其能量变化如图所示。H…H…Cl表示反应物分子旧化学键没有完全断裂、新化学键没有完全形成的过渡态。

该基元反应的活化能为
(4)键能也可以用于估算化学反应的反应热(ΔH)。下表是部分化学键的键能数据:
| 化学键 | P—P | P—O | O=O | P=O |
| 键能/ (kJ·mol-1) | 172 | 335 | 498 | X |
已知白磷的标准燃烧热为-2 378.0 kJ·mol-1,白磷完全燃烧的产物结构如图所示,则上表中X=

(5)已知:Ⅰ.C(石墨,s)+O2(g)=CO2(g) ΔH1=-393.5 kJ·mol-1
Ⅱ.2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ·mol-1
Ⅲ.2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2 599.2 kJ·mol-1
则由C(石墨,s)和H2(g)反应生成1 mol C2H2(g)的焓变为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网