解答题-原理综合题 较难0.4 引用4 组卷940
Na2SO3、NaHSO3是常见的化工原料,常用作还原剂。
(1)25℃,H2SO3、HSO 、SO
、SO 的物质的量分数[
的物质的量分数[ ]与pH的关系如图所示。
]与pH的关系如图所示。
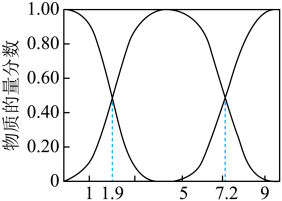
①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为_____ 时应停止通入。
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是_____ (用溶液中所含微粒的物质的量浓度表示)。
③NaHSO3溶液的酸碱性:_____ 。
④若测得25℃时,某溶液中 =10,则溶液的pH为
=10,则溶液的pH为____ 。
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol•L-1I2标准溶液28mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000mol•L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16mL。
①如何判断滴定终点:______ 。
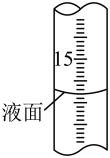
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为_____ mL。
③计算久置Na2SO3固体中Na2SO3的质量分数为____
④下列情况会造成样品中Na2SO3含量测定结果偏低的是____ (填序号)。
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
(1)25℃,H2SO3、HSO

①若向NaOH溶液中通入SO2制取NaHSO3溶液,则当溶液的pH为
②向NaOH溶液中通入SO2,所得溶液中一定存在的等式是
③NaHSO3溶液的酸碱性:
④若测得25℃时,某溶液中
(2)Na2SO3固体久置后会被氧化,为测定某久置Na2SO3固体中Na2SO3的含量,现进行如下实验:称取0.3000g该固体于锥形瓶中,加水溶解后,边振荡边向其中滴加0.1000mol•L-1I2标准溶液28mL,充分反应后,向溶液中滴加2滴淀粉溶液作指示剂,继续滴加0.1000mol•L-1Na2S2O3标准溶液与过量的I2反应(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),恰好完全反应时消耗Na2S2O3标准溶液16mL。
①如何判断滴定终点:
②滴定过程中,滴定管液面如图所示,此时滴定管的读数为

③计算久置Na2SO3固体中Na2SO3的质量分数为
④下列情况会造成样品中Na2SO3含量测定结果偏低的是
A.滴定过程中用蒸馏水冲洗锥形瓶瓶壁
B.装Na2S2O3标准溶液的滴定管水洗后未润洗
C.开始滴定时,滴定管尖嘴部分未充满液体
D.滴定前仰视读数,滴定后俯视读数
22-23高二上·重庆万州·阶段练习
类题推荐
某学生用0.2000mol•L-1NaOH溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
①移取15.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
回答以下填空:
(1)正确操作的顺序是(填序号)②→______→______→______→①→______。______
(2)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的______ 操作(填“甲”、“乙”、“丙”)。

(3)下列情况可能造成测定结果偏高的是______ (填标号)。
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用NaOH固体中含少量NaCl杂质
II.工业废水中常含有一定量氧化性较强的Cr2O ,利用滴定原理测定Cr2O
,利用滴定原理测定Cr2O 含量方法如下:
含量方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:Cr2O +6I-+14H+=2Cr3++3I2+7H2O。
+6I-+14H+=2Cr3++3I2+7H2O。
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=2NaI+Na2S4O6)
(4)步骤III中滴加的指示剂为______ 。滴定达到终点的实验现象是________ 。
(5)步骤III中a的读数如图所示,则:
①a=______ 。
②Cr2O 的含量为
的含量为______ g•L-1。

①移取15.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2~3滴酚酞
②用标准溶液润洗碱式滴定管2~3次
③把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴部分充满溶液
④取标准NaOH溶液注入碱式滴定管至0刻度以上2~3cm
⑤调节液面至0或0刻度以下,记下读数
⑥把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点,记下滴定管液面的刻度
回答以下填空:
(1)正确操作的顺序是(填序号)②→______→______→______→①→______。
(2)盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用如图中的

(3)下列情况可能造成测定结果偏高的是
A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.碱式滴定管用蒸馏水洗净后,未用标准液润洗
E.配制标准溶液所用NaOH固体中含少量NaCl杂质
II.工业废水中常含有一定量氧化性较强的Cr2O
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:Cr2O
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol•L-1Na2S2O3溶液进行滴定,数据记录如下:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(5)步骤III中a的读数如图所示,则:
①a=
②Cr2O

实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH +6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
+6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1molH+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
(1)根据步骤Ⅲ填空:
滴定时边滴边摇动锥形瓶,眼睛应观察____ 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)滴定过程中,下列操作会使结果偏大的是___ 。
A.滴加NaOH时开始平视滴定管,结束时俯视滴定管。
B.装标准NaOH溶液的滴定管未用标准NaOH溶液润洗。
C.锥形瓶用蒸馏水洗涤后,水未倒尽
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
E.滴定过程中,部分碱液滴到锥形瓶外
(3)判断反应达到滴定终点的现象是____ 。
(4)滴定结果如下表所示:
若NaOH标准溶液的浓度为0.1000mol•L-1,则该样品中氮的质量分数为___ 。
步骤I:称取样品1.500g
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次
(1)根据步骤Ⅲ填空:
滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)滴定过程中,下列操作会使结果偏大的是
A.滴加NaOH时开始平视滴定管,结束时俯视滴定管。
B.装标准NaOH溶液的滴定管未用标准NaOH溶液润洗。
C.锥形瓶用蒸馏水洗涤后,水未倒尽
D.滴定前滴定管尖嘴处有气泡,滴定后气泡消失
E.滴定过程中,部分碱液滴到锥形瓶外
(3)判断反应达到滴定终点的现象是
(4)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 1.20 | 20.20 |
工业废水中常含有一定量氧化性较强的 ,利用滴定原理测定
,利用滴定原理测定 含量(通常以1L废水中的微粒质量计量)的方法如下:
含量(通常以1L废水中的微粒质量计量)的方法如下:
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应: +6I-+14H+=2Cr3++3I2+7H2O
+6I-+14H+=2Cr3++3I2+7H2O
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
(1)取Na2S2O3固体配制100mL0.1000mol/LNa2S2O3溶液需要的定量仪器有托盘天平、量筒和___________ 。
(2)步骤I量取30.00mL废水选择的仪器是___________ 。
(3)步骤III中滴加的指示剂为___________ ;滴定达到终点时的实验现象是___________ 。
(4)步骤III中a的读数如图所示,则:___________ mL。
②计算废水中 含量为
含量为___________ g/L。
(5)以下操作会造成废水中 含量测定值偏高的是___________(填字母)。
含量测定值偏高的是___________(填字母)。
步骤I:量取30.00mL废水于锥形瓶中,加入适量稀硫酸酸化。
步骤II:加入过量的碘化钾溶液充分反应:
步骤III:向锥形瓶中滴入几滴指示剂。用滴定管量取0.1000mol/LNa2S2O3溶液进行滴定,数据记录如表:(I2+2Na2S2O3=2NaI+Na2S4O6)
| 滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
| 第一次 | 1.02 | 19.03 |
| 第二次 | 2.00 | 19.99 |
| 第三次 | 0.20 | a |
(2)步骤I量取30.00mL废水选择的仪器是
(3)步骤III中滴加的指示剂为
(4)步骤III中a的读数如图所示,则:
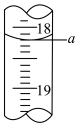
②计算废水中
(5)以下操作会造成废水中
| A.滴定终点读数时,俯视滴定管的刻度 |
| B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.量取Na2S2O3溶液的滴定管用蒸馏水洗后未用标准液润洗 |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


