解答题-原理综合题 适中0.65 引用1 组卷189
合成氨反应是目前最有效的工业固氮方法,解决数亿人口生存问题。
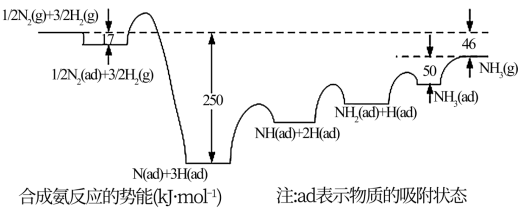
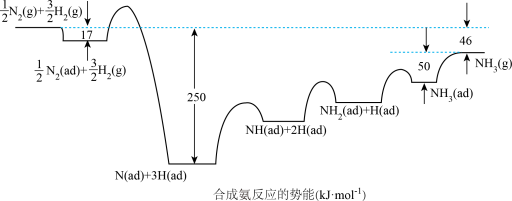
(1)诺贝尔奖获得者埃特尔提出了合成氨反应N2(g)+3H2(g) 2NH3(g)吸附解离的机理,通过实验测得合成氨势能如图1所示,其中吸附在催化剂表面的物种用“d”表示。
2NH3(g)吸附解离的机理,通过实验测得合成氨势能如图1所示,其中吸附在催化剂表面的物种用“d”表示。

①由图可知合成氨反应 N2(g)+
N2(g)+ H2(g)
H2(g) NH3(g)的△H=
NH3(g)的△H=____ ,该历程中反应速率最慢步骤的化学方程式为_____ 。
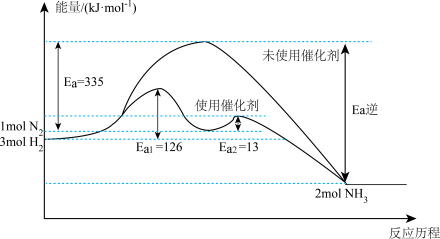
②如图2所示,合成氨反应N2(g)+3H2(g) 2NH3(g)中未使用催化剂时,逆反应的活化能Ea(逆)=
2NH3(g)中未使用催化剂时,逆反应的活化能Ea(逆)=____ kJ•mol-1;使用催化剂之后,正反应的活化能为____ kJ•mol-1。

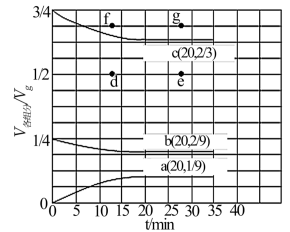
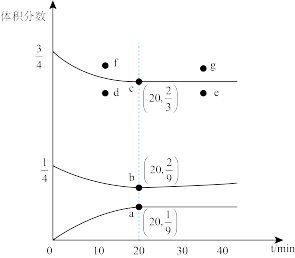
(2)t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)]为3的混合气体,体系中气体的含量与时间变化关系如图3所示:
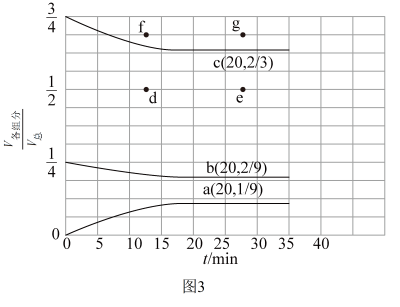
反应20min达到平衡,试求0~20min内氨气的平均反应速率 (NH3)=
(NH3)=____ MPa•min-1。若起始条件一样,在恒容容器中发生反应,则达到平衡时H2的含量符合图中____ 点(填“d”、“e”、“f”或“g”)。
(3)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为3时,平衡时氨气的含量关系式为:ω(NH3)=0.325•Kp•P•(1-i)2:(Kp平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为500℃,不含惰性气体时,平衡体系压强为2.4MPa,氨气的含量为ω,若此时增大压强,Kp____ 将(填“变大”、“变小”或“不变”)。若温度不变,体系中有20%的惰性气体,欲使平衡时氨气的含量仍为ω,压强调整至____ MPa。
(1)诺贝尔奖获得者埃特尔提出了合成氨反应N2(g)+3H2(g)

①由图可知合成氨反应
②如图2所示,合成氨反应N2(g)+3H2(g)

(2)t℃、压强为3.6MPa条件下,向一恒压密闭容器中通入氢氮比[c(H2):c(N2)]为3的混合气体,体系中气体的含量与时间变化关系如图3所示:

反应20min达到平衡,试求0~20min内氨气的平均反应速率
(3)在合成氨工艺中,未反应的气体(含不参与反应的惰性气体)可多次循环使用。当氢氮比[c(H2):c(N2)]为3时,平衡时氨气的含量关系式为:ω(NH3)=0.325•Kp•P•(1-i)2:(Kp平衡常数;P:平衡体系压强;i:惰性气体体积分数)。当温度为500℃,不含惰性气体时,平衡体系压强为2.4MPa,氨气的含量为ω,若此时增大压强,Kp
22-23高二上·广东广州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网