解答题-原理综合题 较难0.4 引用1 组卷249
世界多国相继规划了碳达峰碳中和时间节点,我国提出在2060年前实现碳中和。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。目前,研究比较多的是利用CO2合成甲醇、甲酸和乙酸。
I.CO2催化加氢合成甲醇:
(1)反应方程式为:CO2(g)+3H2(g) CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
已知反应中相关化学键键能数据如下:
①该反应的∆H=___________ 。
在密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生反应:CO2(g) +3H2(g) CH3OH(g) +H2O(g) ,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
CH3OH(g) +H2O(g) ,实验测得平衡时甲醇的物质的量随温度、压强的变化如图所示。
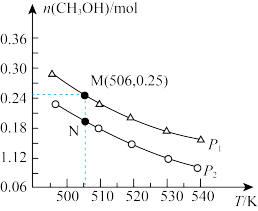
②M、N两点的化学反应速率:v( N)___________ v(M),判断理由是___________ 。
③为提高CO2的转化率,除改变温度和压强外,还可以采取的措施是___________ 。
④若506K时,在10L密闭容器中反应,达平衡时恰好处于图中M点,则N点对应的平衡常数K=___________ ( 保留两位小数)。
II. CO2催化加氢合成甲酸:
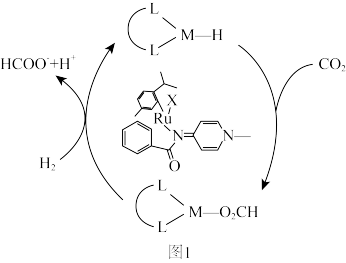
(2)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图1所示,图中含Ru配合物的某段结构用M表示。该反应的中间体为___________ ,研究表明,极性溶剂有助于促进CO2插入M—H 键,使用极性溶剂后极大地提高了整个反应的合成效率,原因是___________ 。
III.我国科学家首次用CO2高效合成乙酸,其反应路径如图2所示:
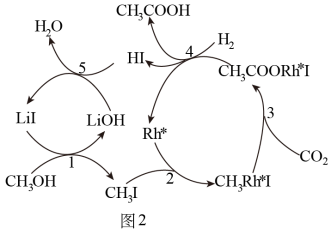
(3)①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式___________ 。
②根据图示,写出总反应的化学方程式:___________ 。
I.CO2催化加氢合成甲醇:
(1)反应方程式为:CO2(g)+3H2(g)
已知反应中相关化学键键能数据如下:
| 化学键 | H-H | C=O | C-H | C-O | O-H |
| kJ·mol-1 | 436 | 803 | 414 | 326 | 465 |
①该反应的∆H=
在密闭容器中投入1 mol CO2和2.75 mol H2,在不同条件下发生反应:CO2(g) +3H2(g)

②M、N两点的化学反应速率:v( N)
③为提高CO2的转化率,除改变温度和压强外,还可以采取的措施是
④若506K时,在10L密闭容器中反应,达平衡时恰好处于图中M点,则N点对应的平衡常数K=
II. CO2催化加氢合成甲酸:
(2)利用CO2在新型钌配合物催化剂下加氢合成甲酸,反应机理如图1所示,图中含Ru配合物的某段结构用M表示。该反应的中间体为

III.我国科学家首次用CO2高效合成乙酸,其反应路径如图2所示:

(3)①原料中的CH3OH可通过电解法由CO2制取,用稀硫酸作电解质溶液,写出生成CH3OH的电极反应式
②根据图示,写出总反应的化学方程式:
2022·新疆乌鲁木齐·一模
知识点:根据△H=反应物的键能之和-生成物的键能之和进行计算化学平衡图像分析化学平衡常数的有关计算电解池电极反应式及化学方程式的书写与判断 答案解析 【答案】很抱歉,登录后才可免费查看答案和解析! 立即登录
类题推荐
当今,世界多国相继规划了碳达峰、碳中和的时间节点,我国提出争取 2030 年“碳达峰”,2060 年“碳中和”。因此,研发二氧化碳利用技术、降低空气中二氧化碳含量成为热点。
(1)甲醇是一种可再生能源,由 CO2 制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2 (g) CH3OH(g)+H2O (g) △H 1 =-49.58 kJ·mol-1
CH3OH(g)+H2O (g) △H 1 =-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2 (g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ: CO (g)+2H2(g) CH3OH(g) △H3 =-90.77kJ·mol-1
CH3OH(g) △H3 =-90.77kJ·mol-1
则:反应Ⅱ的 ΔH2 =___________ kJ·mol-1 。
(2)若反应 II 在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是___________;
(3)对于反应Ⅰ,不同温度对 CO2的转化率及催化剂的催化效率影响如图所示,下列有关说法正确的是___________。

(4)250℃时,若在 2L 密闭刚性容器中充入 3molH2和 1molCO2 只发生反应Ⅰ,起始压强为 150kpa,反应需 t min 达到平衡,则 v(CH3OH)=___________ kpa·min-1 (用含 t 的代数式表示)。某温度时,用各物质的平衡分压表示反应Ⅰ的平衡常数,表达式Kp=___________ 。
(5)我国科学家研究 Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极 CO2电还原后与锂离子结合形成碳酸锂按以下 4 个步骤进行,写出步骤Ⅲ的离子方程式。
I.2CO2 +2e‑ =C2O
II. C2O =CO2 +CO
=CO2 +CO
III.___________
IV.CO +2Li+=Li 2CO3
+2Li+=Li 2CO3
②研究表明,在电解质水溶液中,CO2 气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为___________ 。
(1)甲醇是一种可再生能源,由 CO2 制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2 (g)
反应Ⅱ:CO2(g)+H2 (g)
反应Ⅲ: CO (g)+2H2(g)
则:反应Ⅱ的 ΔH2 =
(2)若反应 II 在一绝热恒容密闭容器中进行,下面能说明反应已达到平衡状态的是___________;
| A.v(CO)=v(H2O) | B.总压强不变 |
| C.平衡常数不变 | D.容器内 n(CO2)/n(H2O)的值保持不变 |

| A.其他条件不变,若不使用催化剂,则 250℃时 CO2 的平衡转化率可能位于 M1 |
| B.温度低于 250℃时,随温度升高甲醇的平衡产率增大 |
| C.M 点时平衡常数比 N 点时平衡常数大 |
| D.若反应在较低的温度下进行,可以提高 CO2的平衡转化率,符合勒沙特列原理 |
(5)我国科学家研究 Li-CO2电池,取得了重大科研成果。回答下列问题:
①Li-CO2电池中,研究表明该电池反应产物为碳酸锂和单质碳,正极 CO2电还原后与锂离子结合形成碳酸锂按以下 4 个步骤进行,写出步骤Ⅲ的离子方程式。
I.2CO2 +2e‑ =C2O
II. C2O
III.
IV.CO
②研究表明,在电解质水溶液中,CO2 气体可被电化学还原。写出CO2在碱性介质中电还原为正丙醇(CH3CH2CH2OH)的电极反应方程式为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




