解答题-原理综合题 适中0.65 引用2 组卷110
回答下列问题
(1)已知25℃时有关弱酸的电离平衡常数:
①同温度下,等pH值的下列溶液,物质的量浓度由大到小的顺序为_______ (填序号)。
a. b.
b. c.
c.
②25℃时将 溶液和
溶液和 溶液分别与
溶液分别与 溶液混合。
溶液混合。
a.请将产生的气体体积随时间的变化关系表示在坐标中_______ (做好必要的标注)

b.反应结束后所得两溶液中,
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
③向 溶液中通入少量
溶液中通入少量 气体,反应的离子方程式为
气体,反应的离子方程式为_______ 。
(2)煤燃烧的烟气也含氮氧化物,用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知:






在常温下, 催化还原
催化还原 的热化学方程式
的热化学方程式_______
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解 的氯化铜溶液的装置示意图,请回答下列问题:
的氯化铜溶液的装置示意图,请回答下列问题:
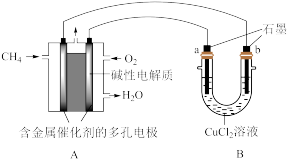
①甲烷燃料电池的负极反应式是_______ ;
②当A中消耗 氧气时,B中
氧气时,B中_______ 极增重_______ g。
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | ||||
| 电离平衡常数 |
a.
②25℃时将
a.请将产生的气体体积随时间的变化关系表示在坐标中

b.反应结束后所得两溶液中,
③向
(2)煤燃烧的烟气也含氮氧化物,用
已知:
在常温下,
(3)电池可以提升能量利用率。下图是利用甲烷燃料电池电解

①甲烷燃料电池的负极反应式是
②当A中消耗
22-23高二上·河南郑州·期中
类题推荐
(1)已知25℃时有关弱酸的电离平衡常数:
①等物质的量浓度的a.CH3COONa、b.NaCN、c.Na2CO3、d.NaHCO3溶液的pH由大到小的顺序为___________ (填序号)。
②25℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是________________________________________________ 。反应结束后所得两溶液中,c(CH3COO-)____ c(SCN-)(填“>”、“<”或“=”)

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是______ (填序号)。
a. c(CH3COO-)
b. c(H+)
c. Kw
d. 醋酸电离平衡常数
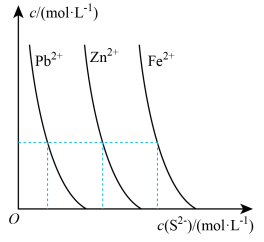
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是___________ (填化学式)。向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为______________ (填化学式)沉淀。
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:
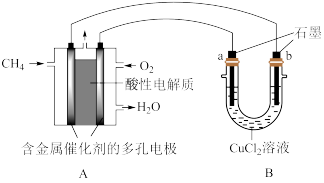
请回答:
① 甲烷燃料电池的负极反应式是__________________________________________ 。
② 当线路中有0.1 mol电子通过时,_______ 极增重________ g
(1)已知25 ℃时有关弱酸的电离平衡常数:
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为__________ (填序号)。
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:________ 反应结束后所得两溶液中,c(SCN-)________ c(CH3COO-)(填“> ”、“< ”或“= ”)
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是______ (填序号)。
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g) N2O4(g) △H=-56.9kJ mol-1
N2O4(g) △H=-56.9kJ mol-1
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式_________
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:
①甲烷燃料电池的负极反应式是____________
② 当A中消耗0.15mol氧气时.B 中____ 极增重_______ g。
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
① 同温度下,等pH值的a. NaHCO3、b. NaCN、c.Na2CO3溶液的物质的量浓度由大到小的顺序为
② 25 ℃时,将20mL 0.1mol/LCH3COOH溶液和20mL0.1mol/LHSCN溶液分别与20ml0.1mol/L NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:

反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是:
③ 若保持温度不变,在醋酸溶液中加入一定量氨气,下列量会变小的是
a.c(CH3COO-) b.c(H+) c.Kwd.醋酸电离平衡常数
(2)煤燃烧产生的烟气也含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ mol-1
2NO2(g)
H2O(g)=H2O(l) △H=-44.0kJ mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(l)的热化学方程式
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解50mL 2mol/L的氯化铜溶液的装置示意图:请回答下列问题:

①甲烷燃料电池的负极反应式是
② 当A中消耗0.15mol氧气时.B 中
(1)已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7K2=5.6×10-11 |
②25℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1HSCN溶液分别与20 mL 0.1 mol·L-1
NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是

③若保持温度不变,在醋酸溶液中加入少量盐酸,下列量会变小的是
a. c(CH3COO-)
b. c(H+)
c. Kw
d. 醋酸电离平衡常数
(2)下图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。如果向三种沉淀中加盐酸,最先溶解的是

(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷
燃料电池电解50 mL 2 mol·L—1的氯化铜溶液的装置示意图:

请回答:
① 甲烷燃料电池的负极反应式是
② 当线路中有0.1 mol电子通过时,
Ⅰ.已知25℃时,醋酸、氢硫酸、氢氰酸的电离平衡常数如下表:
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)___________ 。
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为___________ (填序号)。
(3)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是___________ 。
a.c(H+)<c(OH-)
b.c(H+)+c(HCN)=c(OH-)+c(CN-)
c.c(HCN)+c(CN-)=0.01mol/L
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(4)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为___________ (填“阴极”或“阳极”),阳极产生ClO-的电极反应为___________ ,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为___________ 。
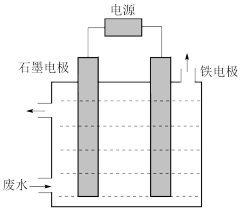
(5)若用碱性甲烷燃料电池做电源,电解一段时间后,甲烷燃料电池中溶液的pH___________ 。(填“增大、减小或不变”)
| 醋酸 | 氢硫酸 | 氢氰酸 |
| Ka=1.8×10-5 | Ka1=9.1×10-8 Ka2=1.1×10-12 | Ka=4.9×10-10 |
(1)体积相同、c(H+)相同的三种酸溶液a.CH3COOH;b.HCN;c.H2SO4分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母)
(2)25℃时,等浓度的三种溶液①NaCN溶液、②Na2S溶液、③CH3COONa溶液,pH由大到小的顺序为
(3)将浓度为0.02mol/L的HCN 与0.01mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(CN-),下列关系正确的是
a.c(H+)<c(OH-)
b.c(H+)+c(HCN)=c(OH-)+c(CN-)
c.c(HCN)+c(CN-)=0.01mol/L
Ⅱ.NaCN是一种重要的基本化工原料,同时也是一种剧毒物质,严重危害人类健康。
(4)含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。其中电解处理法如图:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入一定量的NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为

(5)若用碱性甲烷燃料电池做电源,电解一段时间后,甲烷燃料电池中溶液的pH
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


