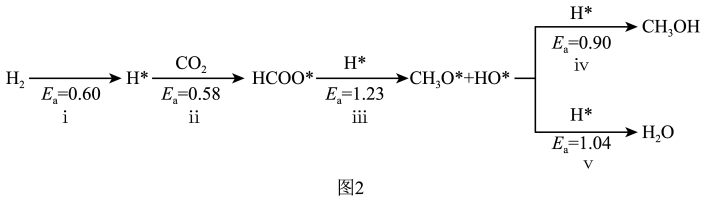
解答题-原理综合题 较难0.4 引用2 组卷355
我国在应对气候变化工作中取得显著成效,并向国际社会承诺2030年实现“碳达峰”,2060年实现“碳
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g) CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
CH2=C(CH3)2(g)+H2O(g)+CO(g) △H1=+165.2kJ·mol-1
反应II:CH3CH(CH3)CH3(g) CH2=C(CH3)2(g)+H2(g) △H2
CH2=C(CH3)2(g)+H2(g) △H2
回答下列问题:
(1)已知:CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=
CO2(g)+H2(g) △H=-41.2kJ·mol-1,则△H2=_______ 。
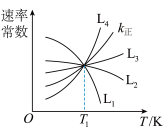
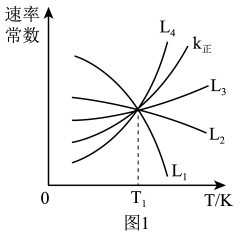
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为_______ (填“L1”“L2”“L3”或“L4”)。
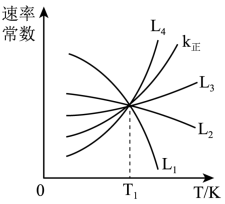
②温度为T1时,该反应的化学平衡常数K=_______ ,平衡时,CH3CH(CH3)CH3的转化率_______ 50%(填“以>”、“=”、“<”)。
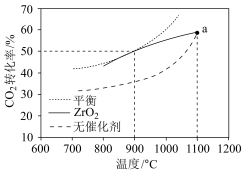
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g) 2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
2CO(g)+2H2(g)。在pMPa时,将CO2和CH4按物质的量之比为1:1充入密闭容器中,分别在无催化剂及ZrO2催化下反应相同时间,测得CO2的转化率与温度的关系如图所示:
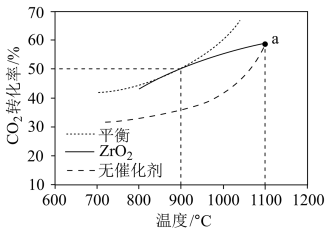
①a点CO2转化率相等的原因是_______ 。
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=_______ (以分压表示,分压=总压×物质的量分数;写出含α、n、p的计算表达式)。
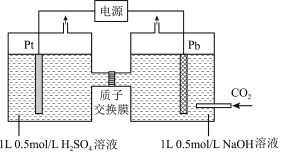
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:_______ 。
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是_______ ,标准状况下,当阳极生成O2的体积为224mL时,测得阴极区内的c(HCOO-)=0.015mol/L,则电解效率_______ 。(忽略电解前后溶液体积的变化)已知:电解效率= 100%。
100%。
中和”。因此将CO2转化为高附加值化学品成为科学家研究的重要课题。异丁烯[CH2=C(CH3)2]作为汽油添加剂的主要成分,可利用异丁烷与CO2反应来制备。
反应I:CH3CH(CH3)CH3(g)+CO2(g)
反应II:CH3CH(CH3)CH3(g)
回答下列问题:
(1)已知:CO(g)+H2O(g)
(2)向1.0L恒容密闭容器中加入1molCH3CH(CH3)CH3(g)和1molCO2(g),利用反应I制备异丁烯。已知正反应速率可表示为v正=k正c[CH3CH(CH3)CH3]·c(CO2),逆反应速率可表示为,v逆=k逆c[CH2=c(CH3)2]·c(H2O)·c(CO),其中k正、K逆为速率常数。
①图中能够代表k逆的曲线为

②温度为T1时,该反应的化学平衡常数K=
(3)CH4-CO2重整技术是实现“碳中和”的一种理想的CO2利用技术,反应为:CO2(g)+CH4(g)

①a点CO2转化率相等的原因是
②在pMPa、900°C、ZrO2催化条件下,将CO2、CH4、H2O按物质的量之比为1:1:n充入密闭容器,CO2的平衡转化率为α,此时平衡常数Kp=
(4)利用电化学可以将CO2有效转化为HCOO-,装置如图所示。

①在该装置中,左侧Pt电极上的电极反应式:
②装置工作时,阴极除有HCOO-生成外,还可能生成副产物降低电解效率。阴极生成的副产物可能是
2022·重庆九龙坡·二模
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网