单选题 适中0.65 引用3 组卷318
CH4与CO2催化重整可以同时利用两种温室气体,其工艺过程中涉及如下反应:
反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=247.4kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=41.2kJ·mol-1
反应Ⅲ:CH4(g)+ O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1
O2(g)⇌CO(g)+2H2(g) ΔH3=-35.6 kJ·mol-1
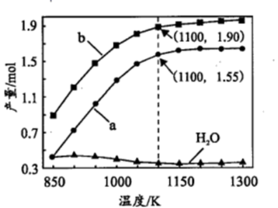
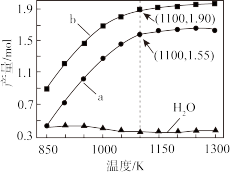
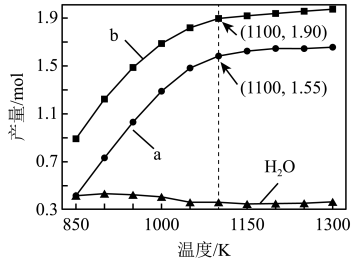
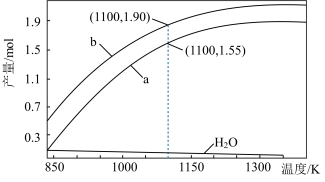
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。下列说法正确的是
反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH1=247.4kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH2=41.2kJ·mol-1
反应Ⅲ:CH4(g)+
一定条件下,向体积为VL的密闭容器中通入CH4、CO2各1.0mol及少量O2,测得不同温度下反应平衡时各产物产量如图所示。下列说法正确的是

| A.图中曲线b表示H2的平衡产量随温度的变化曲线 |
| B.1100K时,CH4与CO2的转化率分别为95%、90%,反应I的平衡常数 |
| C.反应CO(g)+3H2(g)⇌CH4(g)+H2O(g) ΔH=206.2kJ·mol-1 |
| D.若选用其它催化剂可能使平衡时H2O的产量随着温度升高而增加 |
22-23高三上·江苏徐州·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网