填空题 较难0.4 引用1 组卷292
加强对工业废水、废气的处理,可以保护环境,利于健康,某电镀废水中含有重金属铬(Ⅵ)污染物,而硫酸工业会产生废气 ,有人考虑综合处理可降低污染。
,有人考虑综合处理可降低污染。
(1)硫酸工业的尾气中含 等污染性气体,研究发现
等污染性气体,研究发现 溶液可以用来处理废气中的
溶液可以用来处理废气中的 ,产生亚硫酸氢钠,发生反应
,产生亚硫酸氢钠,发生反应 。
。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
①常温时, 溶液呈
溶液呈_________ (填“酸”、“碱”或“中”)性,其原因是_________ (用电离方程式表示)。
②相同物质的量浓度的三种酸溶液HClO、 和
和 由水电离的
由水电离的 最大的是
最大的是_________ (填化学式)
③将未知浓度的 和
和 等体积混合,溶液
等体积混合,溶液 ,分析该溶液中
,分析该溶液中
_________  填“>”,“<”或“=”)。
填“>”,“<”或“=”)。
(2)废水中铬(Ⅵ)主要以 和
和 形式存在,处理的方法是将铬(Ⅵ)还原为
形式存在,处理的方法是将铬(Ⅵ)还原为 ,再转化为
,再转化为 沉淀。常温下,
沉淀。常温下, 与
与 在溶液中存在如下平衡:
在溶液中存在如下平衡: ,该反应的平衡常数
,该反应的平衡常数 。
。
①若废水中Cr(Ⅵ)的总的物质的量浓度 mol·L
mol·L ,要将废水中
,要将废水中 调节为
调节为 ,则需调节溶液的
,则需调节溶液的
_________ 。(忽略调节 时溶液体积的变化)
时溶液体积的变化)
②一种还原酸性废水中 的方法是向其中加入
的方法是向其中加入 ,写出
,写出 所发生反应的离子方程式:
所发生反应的离子方程式:_________
(3)有关该平衡 说法正确的是_________(填序号)
说法正确的是_________(填序号)
(1)硫酸工业的尾气中含
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | HClO | ||
| 电离平衡常数(25℃) |
②相同物质的量浓度的三种酸溶液HClO、
③将未知浓度的
(2)废水中铬(Ⅵ)主要以
①若废水中Cr(Ⅵ)的总的物质的量浓度
②一种还原酸性废水中
(3)有关该平衡
| A.反应达平衡时, |
| B.加入少量水稀释,溶液中离子总数增加 |
| C.溶液的颜色不变,说明反应达到平衡 |
| D.加入少量 |
22-23高二上·广东深圳·期中
类题推荐
硫酸工业的尾气中含 等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,
等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现, 溶液也可以用来处理废气中的
溶液也可以用来处理废气中的 ,发生反应
,发生反应 。
。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
(1)相同物质的量浓度的三种酸溶液 、
、 和
和 由水电离的
由水电离的 最大的是
最大的是_______ (填化学式)
(2)若向 溶液中加入少量水,则溶液中
溶液中加入少量水,则溶液中 将
将_______ (填“增大”、“减小”或“不变”)。
(3)将浓度均为 的
的 和
和 等体积混合,溶液
等体积混合,溶液 。分析该溶液中离子浓度从大到小依次是
。分析该溶液中离子浓度从大到小依次是_______ 。
(4)①下列离子方程式或守恒关系正确的是_______ (填字母)。
A.
B.
C.向亚硫酸溶液中加入氨水至中性:
D. 氨水和
氨水和 溶液等体积混合:
溶液等体积混合: mol/L+c(H2SO3)+c(H+)
mol/L+c(H2SO3)+c(H+)
②向过量 溶液中通入少量
溶液中通入少量 气体,写出离子方程式
气体,写出离子方程式_______ 。
③根据表内数据,计算 溶液的
溶液的
_______ (忽略 的第二步水解)。
的第二步水解)。
(5)测得吸收 后的
后的 和
和 某混合溶液
某混合溶液 ,进行电解制硫酸并再生
,进行电解制硫酸并再生 原理示意图如图所示。
原理示意图如图所示。
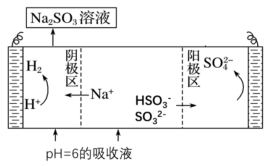
电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是_______ 。
查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
| 弱酸 | |||
| 电离平衡常数 |
(1)相同物质的量浓度的三种酸溶液
(2)若向
(3)将浓度均为
(4)①下列离子方程式或守恒关系正确的是
A.
B.
C.向亚硫酸溶液中加入氨水至中性:
D.
②向过量
③根据表内数据,计算
(5)测得吸收

电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是
硫酸工业的尾气中含SO2等污染性气体,通常用碱液如氨水进行吸收处理,实现绿色环保和废物利用。研究发现,Na2SO3溶液也可以用来处理废气中的SO2,发生反应Na2SO3+SO2+H2O=2NaHSO3,查阅资料可知,常温下,部分弱酸的电离平衡常数如表:
(1)相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是___________ (填化学式)
(2)若向Na2SO3溶液中加入少量水,则溶液中 将
将___________ (填“增大”、“减小”或“不变”)。
(3)将浓度均为0.1mol/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是___________ 。
(4)下列离子方程式或守恒关系正确的是___________(填字母)。
(5)根据表内数据,计算0.06mol/L Na2SO3溶液的pH=______ (忽略SO 的第二步水解)。
的第二步水解)。
(6)测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。
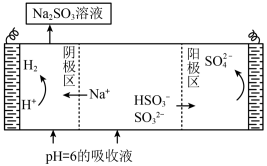
电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是___________ 。
| 弱酸 | HClO | H2CO3 | H2SO3 |
| 电离平衡常数(25℃) | Ka=4.0×10-8 | Ka1=4.3×10-7 Ka2=4.7×10-11 | Ka1=1.5×10-2 Ka2=6×10-8 |
(1)相同物质的量浓度的三种酸溶液HClO、H2CO3和H2SO3由水电离的c(H+)最大的是
(2)若向Na2SO3溶液中加入少量水,则溶液中
(3)将浓度均为0.1mol/L的NaHSO3和Na2SO3等体积混合,溶液pH=7.2。分析该溶液中离子浓度从大到小依次是
(4)下列离子方程式或守恒关系正确的是___________(填字母)。
| A.2ClO-+H2O+SO2=2HClO+ SO |
| B.Cl2+H2O+2CO |
| C.向亚硫酸溶液中加入等浓度等体积的氨水:c(NH |
| D.少量 SO2气体通入过量Na2CO3溶液中,反应的离子方程式为:2CO |
(6)测得吸收SO2后的NaHSO3和Na2SO3某混合溶液pH=6,进行电解制硫酸并再生Na2SO3原理示意图如图所示。

电解时阳极区会产生少量刺激性气体,结合电极方程式分析产生气体的原因是
Ⅰ.结合表回答下列问题(均为常温下的数据):
请回答下列问题:
(1)同浓度的CH3COO-、 、
、 ,
, 、ClO-中结合H+的能力最强的是
、ClO-中结合H+的能力最强的是___________ 。
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________ (填字母)。
A. B.
B. C.
C. D.c(OH-)
D.c(OH-)
(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)___________ V(HClO)(填“>”、“<”或“=”)。
Ⅱ.(4)工业废水中常含有一定量的 和
和 ,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。
,它们会对人体及生态系统产生很大的伤害,必须进行处理。还原沉淀法是常用的一种方法。 ,转化沉淀转化过程中存在平衡,
,转化沉淀转化过程中存在平衡, 能说明反应到达平衡状态的
能说明反应到达平衡状态的___________ 。
A. 和
和 的浓度相同 B.
的浓度相同 B.
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
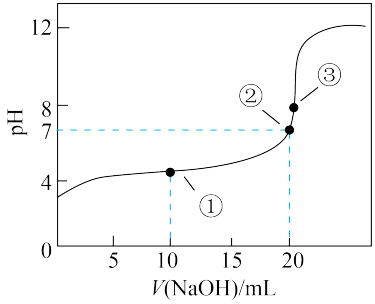
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为___________ 。点③所示溶液中溶质成分为___________ (用化学式表示)。
(6)以下反应的离子方程式书写正确的是___________ 。
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO
B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO
C.Na2CO3溶液吸收少量SO2:2CO + SO2+H2O=SO
+ SO2+H2O=SO +2HCO
+2HCO
| 化学式 | CH3COOH | H2SO3 | HClO | H2CO3 | H2C2O4 |
| 电离平衡常数 | K=1.8×10-5 | K1=1.2×10-2 K2=6.6×10-8 | K=3.0×10-8 | K1=4.4×10-7 K2=4.7×10-11 | K1=5.4×10-2 K2=5.4×10-5 |
请回答下列问题:
(1)同浓度的CH3COO-、
(2)常温下0.1 mol/L的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是
A.
(3)取等体积物质的量浓度相等的CH3COOH、HClO两溶液,别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(CH3COOH)
Ⅱ.(4)工业废水中常含有一定量的
A.
C.溶液的pH值保持不变 D.溶液颜色保持不变
Ⅲ.根据Ⅰ中弱酸的电离平衡常数:
(5)常温下,用0.200 mol/L NaOH溶液滴定20.00 mL某未知浓度的H2C2O4溶液,滴定曲线如图,③点所示溶液中:2c(C2O42-)+2c(HC2O4-)+2c(H2C2O4)=c(Na+)。点①所示溶液中该草酸溶液中离子浓度大小关系为

(6)以下反应的离子方程式书写正确的是
A.次氯酸钠溶液吸收少量二氧化硫:ClO-+SO2+H2O=HClO+SO
B.漂白液生效的原理:ClO-+CO2+H2O=HClO+HCO
C.Na2CO3溶液吸收少量SO2:2CO
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


