填空题 适中0.65 引用1 组卷38
用图示方法表示你对电离平衡、水解平衡、沉淀溶解平衡的认识________ 。
20-21高二·全国·课时练习
类题推荐
部分弱酸的电离常数如下表:
(1)同温同物质的量浓度的HCOONa(aq)与NaClO(aq)中pH大的是________ 。
(2)1molCl2与2molNa2CO3(aq)反应除生成NaCl外还有_______________ (填化学式)。
(3)向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为__________ 。亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
| 弱酸 | HCOOH | HClO | H2CO3 | H2SO3 |
| 电离常数 (25℃) |
(1)同温同物质的量浓度的HCOONa(aq)与NaClO(aq)中pH大的是
(2)1molCl2与2molNa2CO3(aq)反应除生成NaCl外还有
(3)向一定量的NaHCO3(aq)中通入少量的SO2(g),反应的离子方程式为
含氯物质在生产、生活中有重要作用。工业上常用次氯酸钠处理含有NO等氮氧化物的尾气,反应方程式如下:NaClO + NO + H2O —— NaCl + HNO3 (未配平)。完成下列填空。
(1)氯在元素周期表中的位置是______________________________ ,其所在主族的元素中,最高价氧化物对应的水化物酸性最强的是_______________ (填化学式)。
(2)配平上述反应方程式_______ 。
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为____________ L。
(3)NaClO溶液中存在如下关系:c(OH-)_____ c(HClO)(填“>”、“=”、或“<”)。
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。
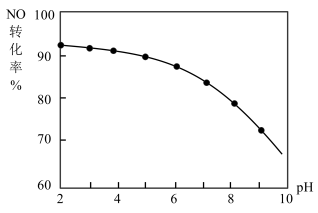
(4)NaClO溶液的初始pH越大,NO的转化率越________________ (填“高”或“低”),其原因是_____________________ 。取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
(1)氯在元素周期表中的位置是
(2)配平上述反应方程式
每有0.3mol电子发生转移,可消耗标准状况下NO气体的体积约为
(3)NaClO溶液中存在如下关系:c(OH-)
其他条件相同,随着NaClO溶液初始pH(用稀硫酸调节)的不同,NO转化率如图。

(4)NaClO溶液的初始pH越大,NO的转化率越
(5)取少量NaClO溶液和KClO3溶液,分别置于A试管和B试管,滴加试剂,观察现象,记录于下表。
请将表格填写完整。
滴加KI溶液 | 再滴加CCl4,振荡、静置 | 结论 | |
A试管 | 溶液变为棕黄色 | 溶液分层,下层显 | 氧化性强弱:(填“>”或“<”) KClO3 |
B试管 | 无现象 | 溶液分层,均无色 |
I.25℃时,对比下列两种溶液,填空。
(1)两溶液中c(OH-):甲____ 乙(填“<”、“=”或“>”,下同)。
(2)两溶液中溶液的物质的量浓度:甲____ 乙。
(3)两溶液分别加水稀释10倍,稀释后溶液的pH:甲____ 乙。
(4)等体积的甲、乙两溶液分别与丙溶液完全中和,消耗盐酸的体积:甲____ 乙。
(5)已知:lg2≈0.3,则等体积的乙与丙溶液混合后(忽略混合过程中的溶液体积变化),溶液的pH约为____ 。
II.醋酸是我们很熟悉的一种有机物。
(6)醋酸的电离方程式为____ 。
(7)某同学为了了解醋酸溶液的导电性进行了相应实验,如图为冰醋酸(无水醋酸晶体)在稀释过程中溶液的导电性变化关系图。
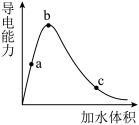
①在稀释过程中,a、b、c三处溶液的pH由大到小的顺序是____ 。
②从b点到c点,溶液中 的比值
的比值____ (填“增大”、“减小”或“不变”)。
③b点时溶液除水以外各种分子、离子的浓度由大到小的顺序是____ 。
III.已知25℃时有关弱酸的电离平衡常数:
(8)相同物质的量浓度的HF、HClO溶液中,水的电离程度大的是____ 溶液。
(9)NaClO溶液显____ (填“酸”、“碱”或“中”)性,原因是____ (用化学用语表示)。
(10)NaClO溶液与少量CO2反应的离子方程式是____ 。
(11)将0.02mol/L的HF与0.01mol/L的NaOH溶液等体积混合后,溶液呈酸性,以下说法正确的是____ (填序号)。
(12)经测定,NaHSO3溶液呈酸性,其原因是____ 。
(13)氯水可用作消毒剂。
①若需增大氯水中的次氯酸的浓度,可向氯水中加入足量的____ (填序号)。
A.Na2CO3B.NaHCO3C.Na2SO3D.NaHSO3
②请用化学平衡移动的原理解释其原因:____ 。
③请用离子方程式表示C可以或不可以的原因:____ 。
| 甲 | 乙 | 丙 | |
| 物质的量浓度(mol/L) | 0.10 | ||
| pH | 10 | 10 | |
| 溶液 | 氨水 | 氢氧化钠溶液 | 盐酸 |
(2)两溶液中溶液的物质的量浓度:甲
(3)两溶液分别加水稀释10倍,稀释后溶液的pH:甲
(4)等体积的甲、乙两溶液分别与丙溶液完全中和,消耗盐酸的体积:甲
(5)已知:lg2≈0.3,则等体积的乙与丙溶液混合后(忽略混合过程中的溶液体积变化),溶液的pH约为
II.醋酸是我们很熟悉的一种有机物。
(6)醋酸的电离方程式为
(7)某同学为了了解醋酸溶液的导电性进行了相应实验,如图为冰醋酸(无水醋酸晶体)在稀释过程中溶液的导电性变化关系图。

①在稀释过程中,a、b、c三处溶液的pH由大到小的顺序是
②从b点到c点,溶液中
③b点时溶液除水以外各种分子、离子的浓度由大到小的顺序是
III.已知25℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | HF | HClO | H2CO3 | H2SO3 |
| 电离平衡常数 | 6.6×10-4 | 4.2×10-8 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.23×10-2 K2=6.6×10-8 |
(9)NaClO溶液显
(10)NaClO溶液与少量CO2反应的离子方程式是
(11)将0.02mol/L的HF与0.01mol/L的NaOH溶液等体积混合后,溶液呈酸性,以下说法正确的是
| A.相同条件下,HF的电离程度大于F-的水解程度 |
| B.c(Na+)+c(H+)=c(F-)+c(OH-) |
| C.c(HF)+c(F-)=2c(Na+)=0.02mol/L |
| D.c(Na+)>c(F-)>c(HF)>c(H+)>c(OH-) |
(13)氯水可用作消毒剂。
①若需增大氯水中的次氯酸的浓度,可向氯水中加入足量的
A.Na2CO3B.NaHCO3C.Na2SO3D.NaHSO3
②请用化学平衡移动的原理解释其原因:
③请用离子方程式表示C可以或不可以的原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


