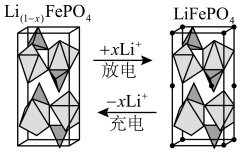
解答题-原理综合题 适中0.65 引用1 组卷40
氢气是一种新型的绿色能源,又是一种重要的化工原料。
Ⅰ.用太阳能分解水制备 是一项新技术,其过程如图:
是一项新技术,其过程如图:
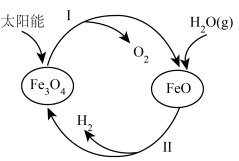
已知:



(1)过程Ⅱ的热化学方程式为___________ 。
Ⅱ.生物材质(以C计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生 两步构成。其中气化炉中涉及的反应有:
两步构成。其中气化炉中涉及的反应有:
① ;
;
② ;
;
③ ;
;
(2)该工艺制 总反应可表示为
总反应可表示为 ,其反应的平衡常数
,其反应的平衡常数
___________ (用 、
、 、
、 的代数式表示)。
的代数式表示)。
(3)在一容积可变的密闭容器中进行反应①。恒温恒压条件下,向其中加入 碳和
碳和 水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为
水蒸气,达到平衡时,容器的体积变为原来的1.25倍,平衡时水蒸气的平衡转化率为___________ ;向该容器中补充 炭,水蒸气的转化率将
炭,水蒸气的转化率将___________ (填“增大”、“减小”或“不变”)。
(4)恒温恒容条件下,对于反应③,若平衡时再充入 ,使其浓度增大到原来的2倍,则平衡
,使其浓度增大到原来的2倍,则平衡___________ 移动(填“向右”、“向左”或“不”);当重新平衡后, 浓度
浓度___________ (填“变大”“变小”或“不变”)。
Ⅰ.用太阳能分解水制备

已知:
(1)过程Ⅱ的热化学方程式为
Ⅱ.生物材质(以C计)与水蒸气反应制取是一种低耗能,高效率的制方法。该方法由气化炉制造和燃烧炉再生
①
②
③
(2)该工艺制
(3)在一容积可变的密闭容器中进行反应①。恒温恒压条件下,向其中加入
(4)恒温恒容条件下,对于反应③,若平衡时再充入
22-23高二上·福建·阶段练习
类题推荐
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
I.C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ.CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ.CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=_______________ (用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡状态的是__________ 。
a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
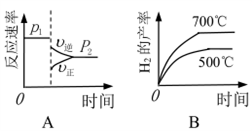
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
由表中数据判断:p1______ p2(填“>”、“<”或“=”)
下列图象正确的是_________ 。
(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为___________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向_____________ (填“正反应”、“逆反应”)方向移动;当重新平衡后,CO2浓度_________ (填“变大”、“变小”或“不变”)。
I.C(s)+H2O(g)
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1; Ⅱ.CO(g)+H2O(g)
 CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2; Ⅲ.CaO(s)+CO2(g)
 CaCO3(s) K3;
CaCO3(s) K3; (1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
 CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=a.容器内混合物的质量不变 b.H2与H2O(g)的物质的量之比不再变化
c.混合气体的密度不再变化 d.形成 a mol H-H键的同时断裂 2 amol H-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
由表中数据判断:p1
下列图象正确的是


(3)已知反应Ⅱ的△H= -41.1 kJ/mol, C=O、O-H、H-H的键能分别为803kJ/mol,464 kJ/mol、436 kJ/mol,则 CO中碳氧键的键能为
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡向
氢气是一种新型的绿色能源,又是一种重要的化工原料。以生物材质(以C 计)与水蒸气反应制取H2是一种低耗能,高效率的制H2方法。该方法由气化炉制造H2和燃烧炉再生CaO两步构成。气化炉中涉及到的反应为:
Ⅰ C(s)+H2O(g) CO(g)+H2(g) K1;
CO(g)+H2(g) K1;
Ⅱ CO(g)+H2O(g) CO2(g)+H2(g) K2;
CO2(g)+H2(g) K2;
Ⅲ CaO(s)+CO2(g) CaCO3(s) K3;
CaCO3(s) K3;
燃烧炉中涉及到的反应为:
Ⅳ C(s)+O2(g)=CO2
Ⅴ CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s) CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=_________ (用K1、K2、K3的代数式表示)。在2L的密闭容器中加入一定量的C(s)、H2O(g)和CaO(s)。下列能说明反应达到平衡的是_______________ 。
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂 2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
下列图像正确的是_________ 。
(3)已知反应Ⅱ的△H=-41.1kJ/mol, C=O、O-H、H-H的键能分别为803KJ/mol,464 kJ/mol、436kJ/mol,则 CO中碳氧键的键能为_________ kJ/mol。
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为_________ ;当重新平衡后,CO2浓度_________ (填“变大”“变小”“不变”)。
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。该电池的总反应为:H+NiOOH M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为
M+Ni(OH)2,其中M为储氢合金材料,则充电过程中的阴极反应式为_______________ 。
Ⅰ C(s)+H2O(g)
Ⅱ CO(g)+H2O(g)
Ⅲ CaO(s)+CO2(g)
燃烧炉中涉及到的反应为:
Ⅳ C(s)+O2(g)=CO2
Ⅴ CaCO3(s)=CaO(s)+CO2(g)
(1)该工艺制H2总反应可表示为C(s)+2H2O(g)+CaO(s)
A.容器内压强不再变化 B.H2与H2O(g)的物质的量之比不再变化
C.混合气体的密度不再变化 D.形成amolH-H键的同时断裂 2amolH-O键
(2)对于反应Ⅰ,不同温度和压强对H2产率影响如下表。
压强 温度 | p1/Mpa | p2/Mpa |
500℃ | 45.6% | 51.3% |
700℃ | 67.8% | 71.6% |
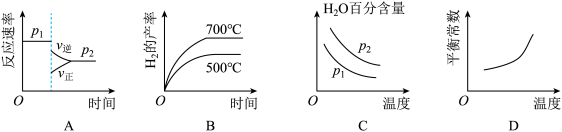
(3)已知反应Ⅱ的△H=-41.1kJ/mol, C=O、O-H、H-H的键能分别为803KJ/mol,464 kJ/mol、436kJ/mol,则 CO中碳氧键的键能为
(4)对于反应Ⅲ,若平衡时再充入CO2,使其浓度增大到原来的2倍,则平衡移动方向为
(5)氢镍电池具有无记忆、无污染,免维护等特点,被称为绿色电池。该电池的总反应为:H+NiOOH
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
 CO(g)+H2(g) K1;
CO(g)+H2(g) K1; CaCO3(s)+2H2(g),其反应的平衡常数K=
CaCO3(s)+2H2(g),其反应的平衡常数K=