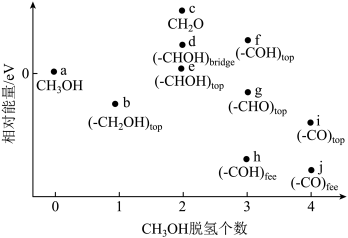
解答题-原理综合题 适中0.65 引用1 组卷70
北京冬奥会上采用二氧化碳跨临界制冰,使人们再次看到了二氧化碳综合化利用的巨大前景。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g) +4H2(g) CH4(g)+2H2O(g) △H
CH4(g)+2H2O(g) △H
①已知H2的燃烧热△H1= - 285. 8 kJ·mol-1,CH4的燃烧热△H2= - 890.3 kJ·mol-1,H2O(g)=H2O(l) △H3= -44 kJ·mol-1,则上述反应的△H=_______ kJ·mol-1。
②相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
a、b、c、d与m、n、x、y之间的关系式为_______ 。
(2)二氧化碳加氢合成甲醇是人工合成淀粉的重要步骤之一,涉及的主要反应如下:
I.CO2(g) + 3H2(g) CH3OH(g)+ H2O(g) △H= -49.5 kJ·mol-1
CH3OH(g)+ H2O(g) △H= -49.5 kJ·mol-1
II.CO(g) +2H2 (g) CH3OH(g) △H= -90.4 kJ·mol-1
CH3OH(g) △H= -90.4 kJ·mol-1
III.CO2(g)+ H2(g) CO(g)+ H2O(g) △H=+40.9 kJ·mol-1
CO(g)+ H2O(g) △H=+40.9 kJ·mol-1
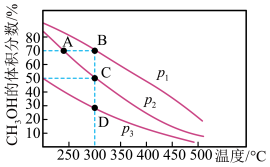
①设 为相对压力平衡常数,是用相对分压(气体分压除以100kPa)代替浓度计算的平衡常数。如下图为反应
为相对压力平衡常数,是用相对分压(气体分压除以100kPa)代替浓度计算的平衡常数。如下图为反应_______ (填“II”或“III”)的lg 随示
随示 (n>m)的变化关系。
(n>m)的变化关系。
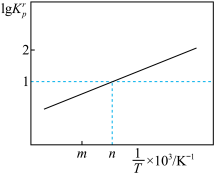
②在上图中n点对应温度下、原料组成为n(CO2): n(H2)=1:3、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为9kPa,H2的平衡转化率为_______ 。
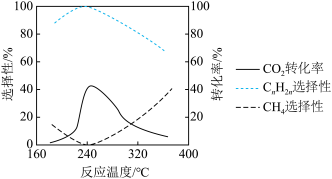
(3)在催化剂的作用下,二氧化碳还可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是_______ 。资料显示原料气中 >1时,随着
>1时,随着 的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是
的增大,低级烯烃的选择性会逐渐降低,但氢气的总转化率不发生明显变化,原因可能是_______ 。
(1)国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2 (g) +4H2(g)
①已知H2的燃烧热△H1= - 285. 8 kJ·mol-1,CH4的燃烧热△H2= - 890.3 kJ·mol-1,H2O(g)=H2O(l) △H3= -44 kJ·mol-1,则上述反应的△H=
②相同温度时,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
| c(CO2)/mol·L-1 | c(H2)/ mol·L-1 | c(CH4)/ mol·L-1 | c(H2O)/ mol·L-1 | |
| 平衡I | a | b | c | d |
| 平衡II | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为
(2)二氧化碳加氢合成甲醇是人工合成淀粉的重要步骤之一,涉及的主要反应如下:
I.CO2(g) + 3H2(g)
II.CO(g) +2H2 (g)
III.CO2(g)+ H2(g)
①设

②在上图中n点对应温度下、原料组成为n(CO2): n(H2)=1:3、初始总压为100 kPa的恒容密闭容器中进行反应,体系达到平衡时CO的分压为10kPa,CH3OH的分压为9kPa,H2的平衡转化率为
(3)在催化剂的作用下,二氧化碳还可以和氢气发生反应生成甲烷和低级烯烃CnH2n(n=2~4)。其它条件一定时,反应温度对CO2转化率CH4选择性、CnH2n选择性的影响如图所示,从生产低级烯烃的角度考虑,最合适的反应温度是

22-23高二上·河南鹤壁·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网