解答题-原理综合题 适中0.65 引用1 组卷260
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与储存,过程如下:
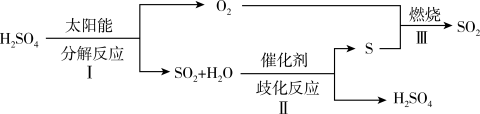
(1)反应I由两步反应完成:a. H2SO4(l) SO3(g)+H2O(g) △H1 = +177 kJ/mol
SO3(g)+H2O(g) △H1 = +177 kJ/mol
b. 2SO3(g) 2SO2(g) +O2(g) △H2 = +197 kJ/mol
2SO2(g) +O2(g) △H2 = +197 kJ/mol
①请写出反应I的热化学反应方程式:_________________________________ 。
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
在实际生产中,选定温度为400~500 ℃的原因是_________________ ;选定压强为常压的原因是_____________________ 。
(2) 可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
可以作为水溶液中SO2歧化反应(反应II)的催化剂,催化历程如下:
i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①请补全反应ii:___________________________________ 。
②比较A、B、C,可得出的结论是:______________________ 。
③D是A的对比实验,则a=__________ 。
④实验表明,SO2的歧化反应速率D>A,则反应速率:i____ ii(填“>”、“=”或“<”)。

(1)反应I由两步反应完成:a. H2SO4(l)
b. 2SO3(g)
①请写出反应I的热化学反应方程式:
②硫酸工业中可通过反应b的逆反应合成SO3,下表列出了不同温度、压强下SO2的平衡转化率:
温度/℃ | SO2的平衡转化率/% | ||||
0.1 MPa | 0.5 MPa | 1 MPa | 5 MPa | 10 MPa | |
450 | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
550 | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
在实际生产中,选定温度为400~500 ℃的原因是
(2)
i.SO2+4I-+4H+= S↓+2I2+2H2O ii.
某实验小组为探究i、ii反应速率与SO2歧化反应速率的关系,进行如下实验:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
A | B | C | D | |
试剂组成 | 0.4 mol/L KI | 0.4 mol/L KI 0.2 mol/L H2SO4 | 0.2 mol/L H2SO4 | 0.2 mol/L KI a mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色成黄色,出现浑浊较A快 |
①请补全反应ii:
②比较A、B、C,可得出的结论是:
③D是A的对比实验,则a=
④实验表明,SO2的歧化反应速率D>A,则反应速率:i
22-23高三上·湖北武汉·期中
类题推荐
近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
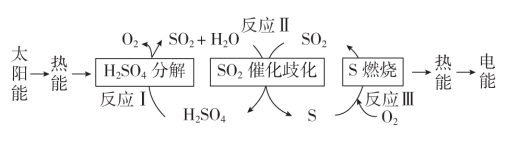
(1)反应Ⅱ:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1;对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
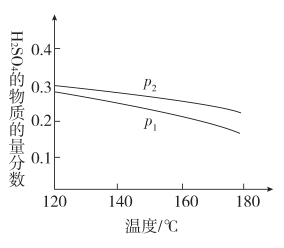
p2_______ p1(填“>”或“<”),得出该结论的理由是_______ 。
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+_______ =_______ +_______ +2I-
(3)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:_______ 。

(1)反应Ⅱ:3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1;对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2
(2)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ⅱ补充完整。
ⅰ.SO2+4I-+4H+=S↓+2I2+2H2O
ⅱ.I2+2H2O+
(3)探究ⅰ、ⅱ反应速率与SO2歧化反应速率的关系,实验如表:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI,0.2mol·L-1 H2SO4 | 0.2mol·L-1H2SO4 | 0.2 mol·L-1 KI,0.0002 mol I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率D>A,结合ⅰ、ⅱ反应速率解释原因:
近年来。研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。已知:SO2歧化反应的离子方程式:3SO2+2H2O=4H++2 +S↓
+S↓
(1)①I-可以作为水溶液中SO2歧化反应的催化剂,可能的歧化过程如下,将ii补充完整_______ 。
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+______=_______+_______+2I-
②请用碰操理论解释:作为该反应的催化剂加快反应速率的原因_______ 。加入催化剂该反应的反应热_______ (填变大、变小、不变)
(2)探究i,ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和液加入到2mL下列试剂中,密闭放置观察现象(已知:I2易溶解在KI溶液中)
①B是A的对比实验,则a=_______ 。
②比较A、B、C,可得出的结论是_______ 。
③实验表明,SO2的歧化反应速率:D>A。结合i,ii反应速率解释原因:_______ 。
(1)①I-可以作为水溶液中SO2歧化反应的催化剂,可能的歧化过程如下,将ii补充完整
i.SO2+4I-+4H+=S↓+2I2+2H2O
ii.I2+2H2O+______=_______+_______+2I-
②请用碰操理论解释:作为该反应的催化剂加快反应速率的原因
(2)探究i,ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和液加入到2mL下列试剂中,密闭放置观察现象(已知:I2易溶解在KI溶液中)
| 序号 | A | B | C | D |
| 试剂组成 | 0.4mol•L-1KI | amol•L-1KI 0.2mol•L-1H2SO4 | 0.2mol•L-1H2SO4 | 0.2mol•L-1KI 0.0002mol•L-1I2 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,出现浑浊较A快 |
②比较A、B、C,可得出的结论是
③实验表明,SO2的歧化反应速率:D>A。结合i,ii反应速率解释原因:
实现太阳能的转化与存储,近年来取得重大突破。利用含硫物质的热化学循环过程如图:
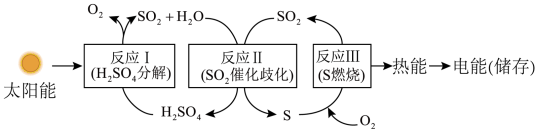
(1)反应Ⅰ由两步反应完成:
a.H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ·mol-1
b.2SO3(g)=2SO2(g)+H2O(g) △H2=+197kJ·mol-1
①反应Ⅰ的热化学方程式为____ 。
②对于反应Ⅰ中的b反应,如图纵坐标y表示SO3平衡转化率(%),横坐标x可表示温度或压强,A、B可表示温度曲线或压强曲线。则
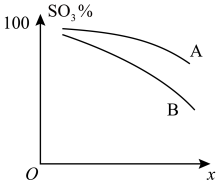
i.横坐标x可表示的物理量是____ 。
ii.当x的量一定时,A、B的大小关系是A____ B(填“<”“>”或“=”)。
(2)已知反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H3=-254kJ·mol-1
①在25℃时,该反应能否自发进行?____ (填“能”“否”或“不能确定”)。
②在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
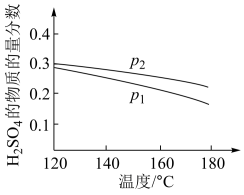
可得出结论p2>p1,其理由是____ 。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
A.SO2+4I-+4H+=S↓+2I2+2H2O
B.I2+2H2O+SO2=4H++SO +2I-
+2I-
欲探究A、B反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL。下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
①b是a的对比实验,则n=____ 。
②比较a、b、c,可得出的结论是___ 。
③实验表明,SO2的歧化反应速率d>a,结合A、B反应速率解释原因:____ 。

(1)反应Ⅰ由两步反应完成:
a.H2SO4(l)=SO3(g)+H2O(g) △H1=+177kJ·mol-1
b.2SO3(g)=2SO2(g)+H2O(g) △H2=+197kJ·mol-1
①反应Ⅰ的热化学方程式为
②对于反应Ⅰ中的b反应,如图纵坐标y表示SO3平衡转化率(%),横坐标x可表示温度或压强,A、B可表示温度曲线或压强曲线。则

i.横坐标x可表示的物理量是
ii.当x的量一定时,A、B的大小关系是A
(2)已知反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s) △H3=-254kJ·mol-1
①在25℃时,该反应能否自发进行?
②在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

可得出结论p2>p1,其理由是
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
A.SO2+4I-+4H+=S↓+2I2+2H2O
B.I2+2H2O+SO2=4H++SO
欲探究A、B反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL。下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
| 实验序号 | 试剂组成 | 实验现象 |
| a | 0.4mol·L-1KI | 溶液变黄,一段时间后出现浑浊 |
| b | nmol·L-1KI、0.2mol·L-1H2SO4 | 溶液变黄,出现浑浊较a快 |
| c | 0.2mol·L-1H2SO4 | 无明显现象 |
| d | 0.2mol·L-1KI、0.0002I2 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较a快 |
②比较a、b、c,可得出的结论是
③实验表明,SO2的歧化反应速率d>a,结合A、B反应速率解释原因:
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


