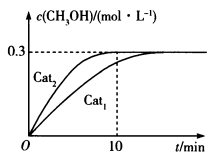
解答题-原理综合题 适中0.65 引用1 组卷52
氨气是重要的化工原料,例如,制造铵态氮肥,作燃料电池的燃料等。
(1)已知合成氨中断裂共价键和形成共价键的能量变化如图所示:

反应 中,生成2mol
中,生成2mol  (g)时
(g)时__________ (填“放出”或“吸收”)__________ kJ能量。
(2)一定温度下,向2L恒容密闭容器中充入1mol (g)和3mol
(g)和3mol  (g)合成氨气,测得混合气体压强随时间变化的曲线如图所示:
(g)合成氨气,测得混合气体压强随时间变化的曲线如图所示:
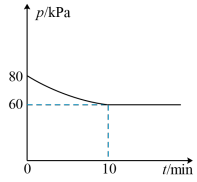
①0~10min内用 的分压表示的平均反应速率为
的分压表示的平均反应速率为__________  。
。
②在该条件下, 的平衡转化率为
的平衡转化率为__________ 。
③下列叙述能说明该反应已达到平衡状态的是__________ (填序号)。
A. B.气体的密度不再发生变化
B.气体的密度不再发生变化
C.各气体之间的质量之比恒定 D.断裂3mol H-H键的同时生成6mol N-H键
(3)氨气碱性燃料电池(以NaOH溶液为电解质溶液)的能量转化率高,电池总反应为
 。放电时,正极附近电解质溶液的pH
。放电时,正极附近电解质溶液的pH__________ (填“升高”“降低”或“不变”);负极的电极反应式为__________________________ 。
(1)已知合成氨中断裂共价键和形成共价键的能量变化如图所示:

反应
(2)一定温度下,向2L恒容密闭容器中充入1mol

①0~10min内用
②在该条件下,
③下列叙述能说明该反应已达到平衡状态的是
A.
C.各气体之间的质量之比恒定 D.断裂3mol H-H键的同时生成6mol N-H键
(3)氨气碱性燃料电池(以NaOH溶液为电解质溶液)的能量转化率高,电池总反应为
22-23高三上·山西·阶段练习
类题推荐
回答下列问题。
(1)化学反应中放出的能量与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。已知: ,生成2molHCl(g)放出185kJ能量,断裂1molH-H键吸收的能量为436KJ,断裂1molCl-Cl键吸收的能量为247kJ,则形成1molH-Cl键放出的能量为
,生成2molHCl(g)放出185kJ能量,断裂1molH-H键吸收的能量为436KJ,断裂1molCl-Cl键吸收的能量为247kJ,则形成1molH-Cl键放出的能量为___________ kJ。
(2)有关的电池装置如下:
①b装置放电过程中,负极的质量___________ (填“增大”、“减小”或“不变”)。
②c装置中,负极材料是___________ 。
③d装置工作时,电子的流向为___________ (填“a→b“或“b→a”),正极的电极反应式为___________ 。
④a装置中,当外电路中转移 时,电解质溶液的质量增加
时,电解质溶液的质量增加___________ g。
(3)反应: 在2L的密闭容器中进行。起始时A和B均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
在2L的密闭容器中进行。起始时A和B均为0.2mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
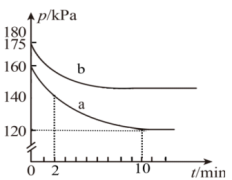
①关于实验a,从反应开始至达到平衡时的反应速率
___________  。
。
②关于实验a,下列叙述正确的是___________ (填序号)。
A.A、B、C的物质的量之比为1∶1∶1时,能说明该反应已达到化学平衡状态
B.B的体积分数不再发生变化,能说明该反应已达到化学平衡状态
C.2min时, 小于
小于
D.某一时刻,容积不变,从容器中分离出A,该反应的反应速率会减小
③对于实验b,用p0表示开始时总压强,p表示平衡时总压强, 表示A的平衡转化率,则
表示A的平衡转化率,则 的表达式为
的表达式为___________ (用p0、p表示)。
(1)化学反应中放出的能量与反应物和生成物在反应过程中断键和形成新键过程中吸收和放出能量的大小有关。已知:
(2)有关的电池装置如下:
| 编号 | 电池装置 | 编号 | 电池装置 |
| a | 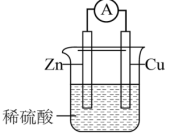 | b |  |
| c | 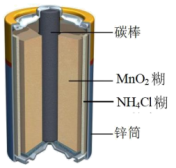 | d |  |
②c装置中,负极材料是
③d装置工作时,电子的流向为
④a装置中,当外电路中转移
(3)反应:

①关于实验a,从反应开始至达到平衡时的反应速率
②关于实验a,下列叙述正确的是
A.A、B、C的物质的量之比为1∶1∶1时,能说明该反应已达到化学平衡状态
B.B的体积分数不再发生变化,能说明该反应已达到化学平衡状态
C.2min时,
D.某一时刻,容积不变,从容器中分离出A,该反应的反应速率会减小
③对于实验b,用p0表示开始时总压强,p表示平衡时总压强,
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网