解答题-原理综合题 适中0.65 引用1 组卷29
甲醇是一种易挥发的液体,它是一种重要的化工原料,也是一种清洁能源。
(1)已知:①

②

③

④

写出表示 燃烧热的热化学方程式:
燃烧热的热化学方程式:_________ 。
(2)不同温度下,将 和
和 通入容积为
通入容积为 的恒容密闭容器中发生如下反应:
的恒容密闭容器中发生如下反应: ,测得体系中
,测得体系中 的体积百分含量随着时间的变化情况如下图所示:
的体积百分含量随着时间的变化情况如下图所示:
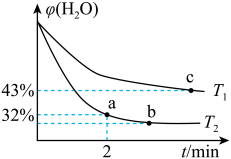
①
_________  (填“>”“<”或“=”,下同),其对应的平衡常数
(填“>”“<”或“=”,下同),其对应的平衡常数
_________  。
。
②温度 下,该反应在密闭容器中到达平衡后,只增大容器的容积,再次到达平衡时,
下,该反应在密闭容器中到达平衡后,只增大容器的容积,再次到达平衡时, 的体积百分含量
的体积百分含量_________ (填“增大”、“减小”或“不变”)。
③ 温度时,若已知该反应
温度时,若已知该反应 时到达平衡,此时
时到达平衡,此时 的体积百分含量为 40%。则从反应开始到平衡时,
的体积百分含量为 40%。则从反应开始到平衡时,
_________ 。
(1)已知:①
②
③
④
写出表示
(2)不同温度下,将

①
②温度
③
22-23高三上·黑龙江牡丹江·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网









