解答题-实验探究题 适中0.65 引用1 组卷105
碳是形成化合物种类最多的元素,其单质及其化合物是人类生产生活的主要能源物质。请回答下列问题:
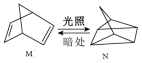
(1)有机物M经过太阳光光照可转化成N,转化过程如下:M N ∆H=+88.6kJ/mol,则M、N相比,较稳定的是
N ∆H=+88.6kJ/mol,则M、N相比,较稳定的是_______ 。
(2)已知CH3OH(l)的燃烧热为-726.5kJ/mol,CH3OH(l)+ O2(g)=CO2(g)+2H2O(g) ∆H=-akJ/mol,则a
O2(g)=CO2(g)+2H2O(g) ∆H=-akJ/mol,则a____ 726.5(填“<”“>”或“=”)
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应生成1molCO2时的热化学方程式:_______ 。
(4)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
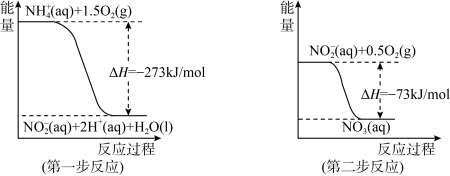
①第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(5)已知H2(g)+Br2(1)=2HBr(g) △H=-72kJ·mol⁻¹,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=_______ 。
(1)有机物M经过太阳光光照可转化成N,转化过程如下:M
(2)已知CH3OH(l)的燃烧热为-726.5kJ/mol,CH3OH(l)+
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1molCl2参与反应时释放出145kJ热量,写出该反应生成1molCO2时的热化学方程式:
(4)在微生物作用的条件下,

①第一步反应是
(5)已知H2(g)+Br2(1)=2HBr(g) △H=-72kJ·mol⁻¹,蒸发1molBr2(l)需要吸收的能量为30kJ,其他相关数据如下表:
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量(kJ) | 436 | 200 | a |
22-23高二上·四川绵阳·期中
类题推荐
回答下列问题:
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:
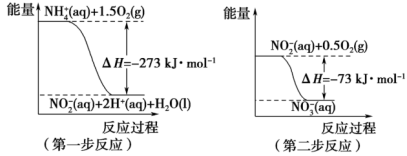
①第一步反应是_______ (填“放热”或“吸热”)反应,判断依据是_______ 。
②1mol NH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_______ 。
(2)已知:
① △H=-566kJ·mol-1
△H=-566kJ·mol-1
② △H=-226 kJ·mol-1
△H=-226 kJ·mol-1
则CO(g)与Na2O2(s)反应放出509kJ热量时,消耗CO的物质的量为_______ 。
(3)已知 △H=-72kJ·mol-1,蒸发1ml Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
△H=-72kJ·mol-1,蒸发1ml Br2(l)需要吸收的能量为30kJ,其他相关数据如下表:
则表中a=_______ 。
(1)在微生物作用的条件下,NH

①第一步反应是
②1mol NH
(2)已知:
①
②
则CO(g)与Na2O2(s)反应放出509kJ热量时,消耗CO的物质的量为
(3)已知
| 物质 | H2(g) | Br2(g) | HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |
则表中a=
回答下列问题
(1)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下:

①第一步反应是________ (填“放热”或“吸热”)反应,判断依据是_______________ 。
②1 mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式是
(aq)的热化学方程式是________________ 。
(2)已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+ O2(g) ΔH=-226 kJ·mol-1②
O2(g) ΔH=-226 kJ·mol-1②
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为________________ 。
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
则表中a=______________ 。
(1)在微生物作用的条件下,NH

①第一步反应是
②1 mol
(2)已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1①
Na2O2(s)+CO2(g)=Na2CO3(s)+
则CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数目为
(3)已知H2(g)+Br2(l)=2HBr(g) ΔH=-72 kJ·mol-1,蒸发1 mol Br2(l)需要吸收的能量为30 kJ,其他相关数据如下表:
物质 | H2(g) | Br2(g) | HBr(g) |
1 mol分子中的化学键断裂时需要吸收的能量/kJ | 436 | 200 | a |
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网