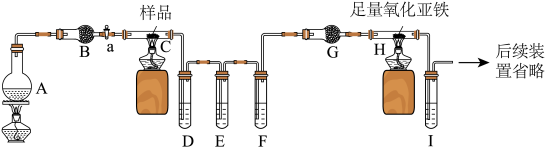
解答题-实验探究题 适中0.65 引用2 组卷219
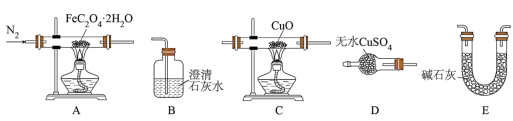
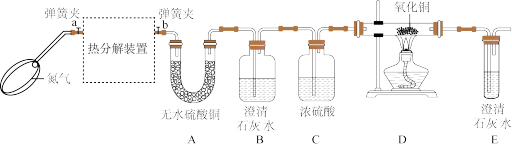
已知:FeC2O4∙nH2O加热至300℃完全失去结晶水,继续加热至400℃,剩余固体又变成黑色,黑色固体为铁的氧化物,同时生成气体,为确定分解产物及n的值,设计了如图所示实验,实验时先打开弹簧夹a、b,鼓入一段时间氮气,然后关闭a,加热热分解装置,资料:无水硫酸铜是白色固体,遇水变蓝;FeO和Fe3O4都是黑色固体。
【实验设计】
【实验分析】
(1)先鼓入氮气,再加热热分解装置的原因是_____________ 。
(2)实验过程中观察到:A中白色固体变蓝,证明产物有_____________ ;B中石灰水变浑浊,证明产物有CO2;D中_____________ (填实验现象),证明产物有CO。
(3)现测得装置D中硬质玻璃管固体质量减轻0.32g,则草酸亚铁晶体分解得到的CO的质量为_____________ 。
(4)上述实验装置不足之处是_____________ 。
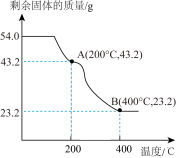
(5)为进一步探究加热至400℃时固体产物的成分,另取1.80gFeC2O4·nH2O重新实验,测得热分解装置中固体质量随温度变化如图所示。
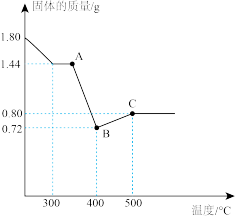
①FeC2O4·nH2O中n的值为_____________ ,若草酸亚铁晶体中混有杂质(杂质不参与反应),会导致测得的值_____________ (填“偏大”、“偏小”或“不变”)。
②AB段发生反应的化学方程式_____________ 。
③将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为_____________ 。
【实验设计】

【实验分析】
(1)先鼓入氮气,再加热热分解装置的原因是
(2)实验过程中观察到:A中白色固体变蓝,证明产物有
(3)现测得装置D中硬质玻璃管固体质量减轻0.32g,则草酸亚铁晶体分解得到的CO的质量为
(4)上述实验装置不足之处是
(5)为进一步探究加热至400℃时固体产物的成分,另取1.80gFeC2O4·nH2O重新实验,测得热分解装置中固体质量随温度变化如图所示。

①FeC2O4·nH2O中n的值为
②AB段发生反应的化学方程式
③将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为
22-23高一上·广东惠州·阶段练习
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网