解答题-原理综合题 适中0.65 引用2 组卷101
放热反应在生产、生活中用途广泛。回答下列问题:
(1)煤油的主要成分为 ,已知
,已知
 完全燃烧生成气态水时放出
完全燃烧生成气态水时放出 热量;
热量;
 。则表示
。则表示 燃烧热的热化学方程式为
燃烧热的热化学方程式为_______ 。
(2)前期的火箭曾用液态肼(N2H4)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出 的热量,则此反应的热化学方程式
的热量,则此反应的热化学方程式_______ 。
(3)甲烷可以消除氮氧化物污染: 。温度为800℃的条件下,向恒容密闭的容器中通入
。温度为800℃的条件下,向恒容密闭的容器中通入 和
和 ,使
,使 、
、 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:
实验1中,在 内,
内,
_______ , 时
时 (正)
(正)_______ (填“大于”“小于”或“等于”) (逆)。
(逆)。
(4) 内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是
内,实验2比实验1反应速率快,则实验1与实验2的“不同条件”是_______ 。
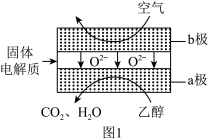
(5)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。a极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。a极电极反应式为_______ ;b极电极反应式为_______ 。
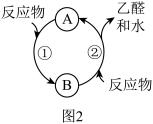
(6)乙酻在Cu作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于_______ (填“催化剂”或“中间产物”)。
(1)煤油的主要成分为
(2)前期的火箭曾用液态肼(N2H4)与双氧水反应来提供能量。已知0.4mol液态肼与足量的双氧水反应,生成氮气和水蒸气,放出
(3)甲烷可以消除氮氧化物污染:
| 实验序号 | 时间/min 浓度/mol/L 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
(4)
(5)乙醇应用于燃料电池,该电池采用可传导

(6)乙酻在Cu作催化剂时与氧气反应的关系如图2所示,整个反应中物质B属于

22-23高三上·湖北·阶段练习
类题推荐
放热反应在生产、生活中用途广泛。
(1)已知 时,
时, 甲烷不完全燃烧生成
甲烷不完全燃烧生成 和液态水时放出
和液态水时放出 热量,则
热量,则 甲烷不完全燃烧的热化学方程式为
甲烷不完全燃烧的热化学方程式为___________ 。
(2)甲烷可以消除氮氧化物污染,发生的反应为 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使 、
、 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在 内,
内,
___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
② 内,实验2比实验1反应速率快的原因可能是
内,实验2比实验1反应速率快的原因可能是___________ 。
(3)乙醇应用于燃料电池,该电池采用可传导 的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为
的固体氧化物为电解质,其工作原理如图1所示。b极电极反应式为___________ 。
(4)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。 高温分解不可能生成
高温分解不可能生成 。理由是
。理由是___________ 。
(1)已知
(2)甲烷可以消除氮氧化物污染,发生的反应为
| 实验序号 | 时间/ 温度 浓度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
②
(3)乙醇应用于燃料电池,该电池采用可传导

(4)硝酸铵在高温或猛烈撞击时易爆炸,放出大量的热。
空气中的氮氧化物主要来源:化石燃料燃烧、工业制硝酸尾气、汽车尾气。
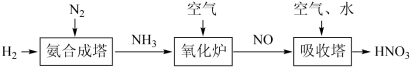
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:___________ 。
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成 和
和 ,其离子方程式为
,其离子方程式为___________ 。
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:___________ 。
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为___________ 。
(5)甲烷与NO2发生的反应为 ,在体积固定的密闭容器中,每次实验均加入
,在体积固定的密闭容器中,每次实验均加入 和
和 ,使
,使 、
、 ,在不同条件下进行反应,测得
,在不同条件下进行反应,测得 随时间的变化情况如下表:
随时间的变化情况如下表:
①实验1中,在10~20min内,
___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是___________ 。
I.请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:
(2)用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性NaClO溶液中,HClO氧化NO生成
(3)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,目前应用最广泛的烟气氮氧化物脱除技术是NH3催化还原氮氧化物(SCR)技术。反应原理如图所示:
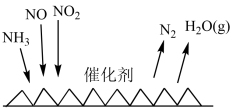
II.甲烷在一定条件下可以消除氮氧化物污染。
(4)已知25℃、101kPa时,1g甲烷不完全燃烧生成CO和液态水时放出37.96kJ热量,则1mol甲烷不完全燃烧的热化学方程式为
(5)甲烷与NO2发生的反应为
| 实验序号 | 时间/min 浓度 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
②0~20min内,实验2比实验1反应速率快的原因可能是
近年来,我国化工技术获得重大突破,利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇(CH3OH)是其中的一个研究项目。该研究发生的主要反应如下:
I.CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
II.CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应不符合原子经济性的是反应___________ (I或II)。
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是___________。
(3)一定温度下,在容积固定的密闭容器中发生反应II,下列说法可以表明反应达到化学平衡状态的是___________。
(4)甲烷可以消除氮氧化物污染,发生的反应为CH4+2NO2 N2+CO2+2H2O,在体积固定的密闭容器中,每次实验均加入CH4和NO2,使c(CH4)=1.0mol·L-1、c(NO2)=2.0mol·L-1,在不同条件下进行反应,测得c(CH4)随时间的变化情况如下表:
N2+CO2+2H2O,在体积固定的密闭容器中,每次实验均加入CH4和NO2,使c(CH4)=1.0mol·L-1、c(NO2)=2.0mol·L-1,在不同条件下进行反应,测得c(CH4)随时间的变化情况如下表:
①实验1中,在10~20min内,v(NO2)=___________ ,40min时v(正)___________ v(逆)(填:“大于”、“小于”、“等于”)。
②0~20min内,实验2比实验1反应速率快的原因可能是___________ 。
(5)H2还原CO电化学法制备甲醇(CO+2H2=CH3OH)的工作原理如图所示:
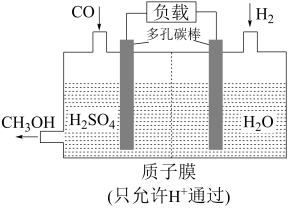
通入CO的一端是电池的___________ 极(填“正”或“负”),电池工作过程中H+通过质子膜向___________ (填“左”或者“右”)移动,通入CO的一端发生的电极反应式为___________ 。
I.CO与H2反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)
II.CO2与H2反应合成甲醇:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)
(1)上述反应不符合原子经济性的是反应
(2)在某一时刻采取下列措施,能使反应I的反应速率减小的措施是___________。
| A.恒温恒容下,再充入CO | B.升高温度 |
| C.恒温恒容下,向其中充入Ar | D.恒温恒压下,向其中充入Ar |
| A.单位时间内消耗3molH2,同时生成lmol的CH3OH |
| B.CH3OH的体积分数不再发生变化 |
| C.3v(CO2)=v(H2) |
| D.容器内气体密度不再改变 |
| 实验序号 | 时间/min 浓度/mol·L-1 温度/℃ | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
②0~20min内,实验2比实验1反应速率快的原因可能是
(5)H2还原CO电化学法制备甲醇(CO+2H2=CH3OH)的工作原理如图所示:

通入CO的一端是电池的
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


