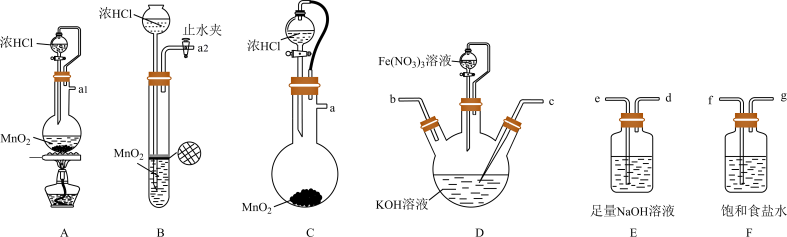
解答题-工业流程题 适中0.65 引用1 组卷277
一种湿化学氧化法合成高铁酸钾(K2FeO4)的工艺流程如下:

实验室可利用如图所示装置制取K2FeO4 (夹持装置略):
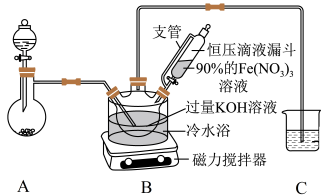
已知:K2FeO4可溶于水,在0~5℃的强碱性溶液中较稳定,酸性、弱碱性时易与水反应。
回答下列问题:
(1)用高锰酸钾固体与浓盐酸通过装置A制氯气时,盛放高锰酸钾的仪器名称为_______ ,装置C中的试剂为_______ 。
(2)上述装置存在一处缺陷,会导致K2FeO4产率降低,改进的方法是_______ 。
(3)装置B中首先制备KClO,然后在剧烈搅拌下将90%的Fe(NO3)3分批加入装置B中,充分反应可得K2FeO4溶液,该反应的化学方程式为_______ ;为了更好地析出K2FeO4,“冷却结晶”时继续补加适量的KOH,作用是_______ 。
(4)流程中“洗涤、干燥”时用无水乙醇洗涤,主要原因是_______ 。
(5)对制得的产品进行定量分析时发生的反应有:



称取2.0g制得的K2FeO4产品溶于适量KOH溶液中,加入足量KCrO2,充分反应后过滤,将滤液转移到250mL容量瓶定容。取25.00mL定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠做指示剂,用0.1mol∙L-1 (NH4)2FeSO4标准溶液滴定,终点由紫色变为绿色,重复操作2次,平均消耗(NH4)2FeSO4溶液的体积为26.00mL。则标准液应选用_______ (填“酸式”或“碱式”)滴定管盛放,该K2FeO4样品的纯度为_______ %。

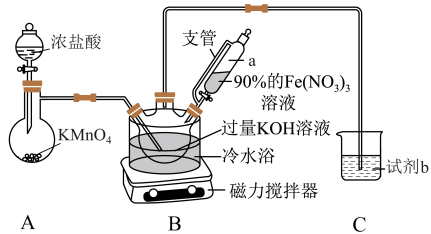
实验室可利用如图所示装置制取K2FeO4 (夹持装置略):

已知:K2FeO4可溶于水,在0~5℃的强碱性溶液中较稳定,酸性、弱碱性时易与水反应。
回答下列问题:
(1)用高锰酸钾固体与浓盐酸通过装置A制氯气时,盛放高锰酸钾的仪器名称为
(2)上述装置存在一处缺陷,会导致K2FeO4产率降低,改进的方法是
(3)装置B中首先制备KClO,然后在剧烈搅拌下将90%的Fe(NO3)3分批加入装置B中,充分反应可得K2FeO4溶液,该反应的化学方程式为
(4)流程中“洗涤、干燥”时用无水乙醇洗涤,主要原因是
(5)对制得的产品进行定量分析时发生的反应有:
称取2.0g制得的K2FeO4产品溶于适量KOH溶液中,加入足量KCrO2,充分反应后过滤,将滤液转移到250mL容量瓶定容。取25.00mL定容后的溶液于锥形瓶,加入稀硫酸酸化,滴加几滴二苯胺磺酸钠做指示剂,用0.1mol∙L-1 (NH4)2FeSO4标准溶液滴定,终点由紫色变为绿色,重复操作2次,平均消耗(NH4)2FeSO4溶液的体积为26.00mL。则标准液应选用
22-23高三上·山东济南·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网
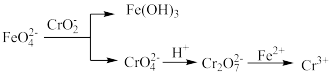 )
)