解答题-原理综合题 困难0.15 引用1 组卷287
(1)二氧化硫在
热化学方程式为:
第1步:
第2步:
第3步:
(2)燃煤发电厂常利用反应
| 浓度 | 时间/min | |||||
| 0 | 10 | 20 | 30 | 40 | 50 | |
| 1.00 | 0.79 | 0.60 | 0.56 | 0.56 | 0.56 | |
| 0 | 0.42 | 0.80 | 0.88 | 0.88 | 0.88 | |
②请写出平衡常数表达式K=
(3)
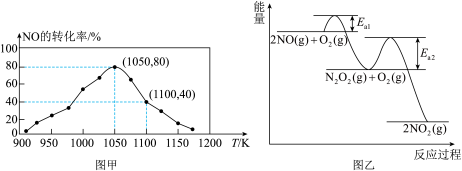
(4)NO氧化反应:
查阅资料知:
Ⅰ:
Ⅱ:
①决定NO氧化反应速率的步骤是
②升高温度绝大多数的化学反应速率增大,但是
a、
c、
③由实验数据得到
22-23高二上·湖北·期中
类题推荐
研究NOx、SO2等大气污染物的妥善处理对于解决化学污染问题具有重要意义。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+ O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=
O2(g)=(NH4)2SO4(aq)+H2O(l) ΔH=___ 。
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g) 2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
2CaSO4(s)+2CO2(g)△H=-681.8kJ•mol-1对煤进行脱硫处理。对于该反应,在温度为TK时,借助传感器测得反应在不同时间点上各物质的浓度如表:
0~10min内,平均反应速率v(O2)=___ mol•L-1•min-1。
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g) N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g)△H=-34.0kJ•mol-1,已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
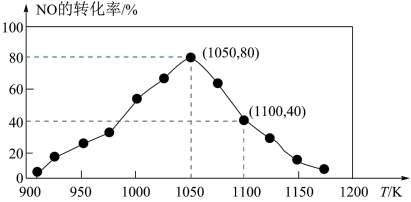
①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是___ ;在1100K时,CO2的体积分数为___ 。
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=___ (已知:气体分压(P分)气体总压(P)×体积分数)
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g) N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
N2(g)+2CO2(g)△H=-746.8kJ•mol-1实验测得,v正=k正c2(NO)•c2(CO),v逆=k逆•c(N2)•c2(CO2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,只升高温度,k正增大的倍数___ (填“>”,“<”或“=”)k逆增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则 =
=___ 。
(1)SO2的排放主要来自于煤的燃烧,工业上常用氨水吸收。吸收过程中相关反应的热化学方程式如下:
①SO2(g)+NH3•H2O(aq)=NH4HSO3(aq) ΔH1=akJ•mol-1
②NH3•H2O(aq)+NH4HSO3(aq)=(NH4)2SO3(ag)+H2O(l) ΔH2=bkJ•mol-1
③2(NH4)2SO3(aq)+O2(g)=2(NH4)2SO4(ag) ΔH3=ckJ•mol-1
则反应SO2(g)+2NH3•H2O(aq)+
(2)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)
| 时间/min 浓度/mol▪L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
(3)NOx的排放主要来自于汽车尾气,有人用活性炭对NO进行吸附,反应为C(s)+2NO(g)

①由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因是
②用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)在1050K、1.1×106Pa时,该反应的化学平衡常数Kp=
(4)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应2NO(g)+2CO(g)
①达到平衡后,只升高温度,k正增大的倍数
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为40%,则
“绿水青山就是金山银山”,因此研究 、
、 等大气污染物的妥善处理具有重要意义。
等大气污染物的妥善处理具有重要意义。
(1) 的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的
的排放主要来自于煤的燃烧,工业上常用氨水吸收法处理尾气中的 。已知吸收过程中相关反应的热化学方程式如下:
。已知吸收过程中相关反应的热化学方程式如下:
①
 ;
;
②
 ;
;
③
 。
。
则反应 的
的
_____ 
(2)燃煤发电厂常利用反应
 对煤进行脱硫处理来减少
对煤进行脱硫处理来减少 的排放。对于该反应,在
的排放。对于该反应,在 时,借助传感器测得反应在不同时间点上各物质的浓度如下:
时,借助传感器测得反应在不同时间点上各物质的浓度如下:
① 内,平均反应速率
内,平均反应速率
________  ;当升高温度,该反应的平衡常数K
;当升高温度,该反应的平衡常数K________  填“增大”“减小”或“不变”
填“增大”“减小”或“不变” 。
。
② 后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是
后,只改变某一条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是________  填字母
填字母 。
。
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3) 的排放主要来自于汽车尾气,有人利用反应
的排放主要来自于汽车尾气,有人利用反应


 ,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
,用活性炭对NO进行吸附。已知在密闭容器中加入足量的C和一定量的NO气体,保持恒压,测得NO的转化率随温度的变化如图所示:
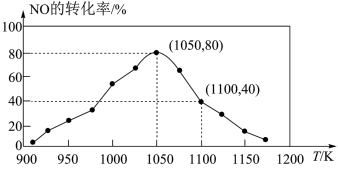
由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为________ ;在1100K时, 的体积分数为
的体积分数为________ 。
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数 记作
记作 。在1050K、
。在1050K、 时,该反应的化学平衡常数
时,该反应的化学平衡常数
________  已知:气体分压
已知:气体分压 气体总压
气体总压 体积分数
体积分数 。
。
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应


 ,生成无毒的
,生成无毒的 和
和 。实验测得,
。实验测得, ,
, 、
、 为速率常数,只与温度有关
为速率常数,只与温度有关 。
。
①达到平衡后,仅升高温度, 增大的倍数
增大的倍数________  填“
填“ ”“
”“ ”或“
”或“ ”
” 增大的倍数。
增大的倍数。
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为 ,则
,则
__________ 。
(1)
①
②
③
则反应
(2)燃煤发电厂常利用反应
| 0 | 10 | 20 | 30 | 40 | 50 | |
| O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
| CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
①
②
A.加入一定量的粉状碳酸钙
B.通入一定量的
C.适当缩小容器的体积
D.加入合适的催化剂
(3)

由图可知,1050K前反应中NO的转化率随温度升高而增大,其原因为
(4)用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数
(5)为避免汽车尾气中的有害气体对大气的污染,需给汽车安装尾气净化装置。在净化装置中CO和NO发生反应
①达到平衡后,仅升高温度,
②若在1L的密闭容器中充入1molCO和1molNO,在一定温度下达到平衡时,CO的转化率为
硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
I.(1)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s)△H=+178.2kJ/mol.
SO2(g)+CaO(s)=CaSO3(g)△H=-402.0kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s)△H=-234.2kJ/mol
写出石灰石脱硫的热化学方程式___ 。
(2)工业上常采用催化还原法处理SO2,不仅可消除SO2污染,而且可得到有经济价值的单质S。用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示。
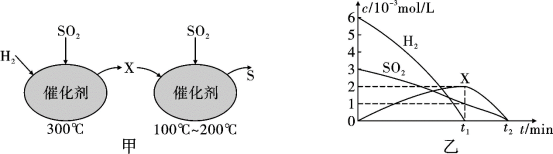
①分析可知X为____ (写化学式),0~t1时间段用SO2表示的化学反应速率为___ 。
②总反应的化学方程式为___ 。
II.NOx主要来自于汽车尾气的排放,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)⇌N2(g)+CO2(g)△H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)△H=-64.2kJ/mol
对于反应a,在T1°C时,借助传感器测得反应在不同时间点上各物质的浓度如下:
(3)①升高反应温度,该反应的平衡常数K___ (选填“增大”、“减小”或“不变”)。
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是____ (填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的容积 D.加入合适的催化剂
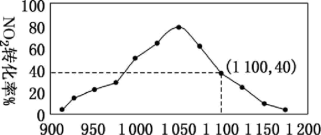
(4)某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间,NO2的转化率随压强变化的示意图。1050kPa前,反应b中NO2转化率随着压强增大而增大的原因___ 。用某物质的平衡分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在T2℃、1100kPa时,该反应的化学平衡常数Kp=____ (计算结果保留小数点后两位)。已知:气体分压(p分)=气体总压(p总)×体积分数。
I.(1)SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s)△H=+178.2kJ/mol.
SO2(g)+CaO(s)=CaSO3(g)△H=-402.0kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s)△H=-234.2kJ/mol
写出石灰石脱硫的热化学方程式
(2)工业上常采用催化还原法处理SO2,不仅可消除SO2污染,而且可得到有经济价值的单质S。用H2还原SO2生成S的反应分两步完成,如图甲所示,该过程中相关物质的物质的量浓度随时间的变化关系如图乙所示。

①分析可知X为
②总反应的化学方程式为
II.NOx主要来自于汽车尾气的排放,包含NO2和NO,有人提出用活性炭对NOx进行吸附,发生反应如下:
反应a:C(s)+2NO(g)⇌N2(g)+CO2(g)△H=-34.0kJ/mol
反应b:2C(s)+2NO2(g)⇌N2(g)+2CO2(g)△H=-64.2kJ/mol
对于反应a,在T1°C时,借助传感器测得反应在不同时间点上各物质的浓度如下:
| 时间(min) 浓度(mol•L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
(3)①升高反应温度,该反应的平衡常数K
②30min后,只改变某一条件,反应重新达到平衡;根据上表中的数据判断改变的条件可能是
A.加入一定量的活性炭 B.通入一定量的NO
C.适当缩小容器的容积 D.加入合适的催化剂
(4)某实验室模拟反应b,在密闭容器中加入足量的C和一定量的NO2气体,维持温度为T2℃,如图为不同压强下反应b经过相同时间,NO2的转化率随压强变化的示意图。1050kPa前,反应b中NO2转化率随着压强增大而增大的原因

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网


