填空题 适中0.65 引用2 组卷141
工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。
已知:反应1:

反应2:

反应3:

(1)①相同质量的C、CO和 完全燃烧时放出的热量由大到小的顺序为
完全燃烧时放出的热量由大到小的顺序为_______ (用化学式表示)。
②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂 分子中的碳氧键需要吸收的热量为
分子中的碳氧键需要吸收的热量为_______ kJ。
(2)水煤气反应:
 。
。
①工业生产水煤气时,通常交替通入 适量的空气和水蒸气与煤炭反应,其理由是_______ 。
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应_______ (填“相等”或“不相等”)。
(3)一氧化碳变换反应:
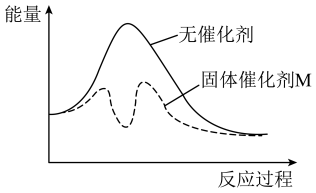
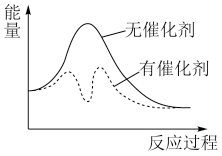
 。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
。以固体催化剂M催化变换反应,反应历程分两步完成,能量-反应过程如图所示。
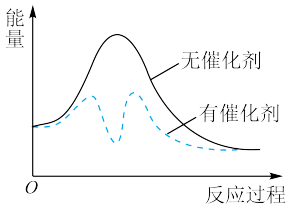
①
_______  。
。
②用两个化学方程式表示该反应历程:
步骤I: 步骤II:
步骤II:_______ 。
③从图中可以看出加入催化剂能够加快反应速率的原因是_______ 。
已知:反应1:
反应2:
反应3:
(1)①相同质量的C、CO和
②25℃,101kPa时,若断裂1mol O=O,1mol C=O需要吸收的能量分别为495kJ、799kJ,则断裂
(2)水煤气反应:
①工业生产水煤气时,通常
②将煤先转化为水煤气再完全燃烧整个过程的热效应与煤直接完全燃烧的热效应
(3)一氧化碳变换反应:

①
②用两个化学方程式表示该反应历程:
步骤I:
③从图中可以看出加入催化剂能够加快反应速率的原因是
22-23高二上·山西·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网