解答题-实验探究题 适中0.65 引用1 组卷84
生活中处处有化学。
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。
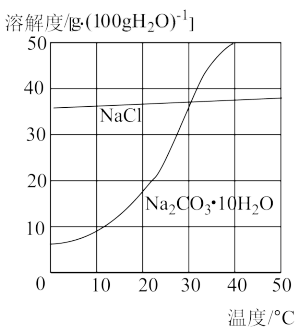
(1)“夏天晒盐”相当于实验室的_______ 法,“冬天捞碱”相当于实验室的_______ 法。
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是_______ 。
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是_______ 。如果不进行纠正,会造成所配溶液的浓度_______ (填“偏高”、“偏低”、“不影响”)
(4)填写实验单中所用仪器的名称:(A)_______ ;(B)_______ ;(C)_______ ;(D)_______ 。
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。按先后顺序 ,说明(B)在实验中的作用:_______ ,_______ 。
(6)实验单中“(_______)”的内容应该是_______ 。
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为_______ (保留三位有效数字)。
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=_______ 。(保留三位有效数字)
Ⅰ.我国西北有很多盐碱湖,湖水中溶有大量的氯化钠和纯碱。在夏天,当地的农民将湖水引入湖滩上晒出了食盐。到了冬天,湖面上又漂浮着大量的石碱晶体(Na2CO3·10H2O),农民则可以直接从湖中捞碱。氯化钠和石碱的溶解度曲线如图所示。

(1)“夏天晒盐”相当于实验室的
(2)为检验所得石碱样品中是否含有NaCl,应使用的试剂是
Ⅱ.为测定石碱样品的质量分数w(Na2CO3·10H2O)(假设只含NaCl杂质),某同学先将样品配成溶液,再测定溶液浓度,最后通过化学反应求出样品的质量分数。
第一步:配制100 mL待测液。该同学的实验单中设计步骤如下:
用电子天平取2.000 g石碱样品,在(A)中加水溶解并冷却至室温后,沿着(B)将液体转移至(C)中。向(C)中直接加水至接近刻度线1~2 cm处,改用(D)逐滴加水至(_______)。摇匀后将液体转移至贴好标签的细口瓶中保存。
(3)该实验单中缺少一个实验步骤,该步骤的名称是
(4)填写实验单中所用仪器的名称:(A)
(5)“配制待测液”的过程中先后两次用到仪器(B),但作用有所区别。
(6)实验单中“(_______)”的内容应该是
第二步:测定待测液浓度:更正第一步中错误操作后,该同学每次取20.00 mL待测液,与0.160 mol·L-1的稀盐酸反应至完全转化为CO2.多次测量后,平均每次消耗盐酸17.40 mL。
(7)该实验测出的碳酸钠溶液的物质的量浓度为
(8)根据实验数据可得出石碱的质量分数w(Na2CO3·10H2O)=
22-23高一上·上海松江·期中
类题推荐
Ⅰ.我国青海省的茶卡盐湖不仅风景优美,也是西北著名的盐湖之一,夏天,人们将湖水引入湖滩上晒出食盐。冬天,湖面上漂浮着大量的纯碱晶体( ),人们可以直接从湖中捞碱。氯化钠和纯碱晶体的溶解度情况如下表所示:
),人们可以直接从湖中捞碱。氯化钠和纯碱晶体的溶解度情况如下表所示:
(1)“冬天捞碱”的原理相当于实验室中的降温结晶法,“夏天晒盐”的原理相当于实验室中的_______ 法。
(2)为检验纯碱样品中是否含有NaCl,应使用的试剂是_______。
Ⅱ.为测定纯碱样品(含NaCl杂质)的质量分数 ,某同学先将样品配成溶液,通过实验测定溶液浓度,最后求出样品中纯碱晶体的质量分数。
,某同学先将样品配成溶液,通过实验测定溶液浓度,最后求出样品中纯碱晶体的质量分数。
(3)实验过程中使用到下列仪器,其中使用前必须检查是否漏水的有_______。
(4)①第一步:配制100 mL样品溶液。
该同学配制溶液的部分过程如下,请写出中间步骤B的具体内容。_______
A.将蒸馏水缓慢注入容量瓶,直到液面接近刻度线l~2cm处。
B……
C.将容量瓶盖好,颠倒摇匀。
将溶液转移至容量瓶时用到了玻璃棒,其作用是_______ 。
②第二步:测定溶液浓度。
该同学量取样品溶液20.00 mL,与0.160 mol·L-1稀盐酸反应至完全转化为 ,消耗盐酸18.00 mL,写出该反应的离子方程式
,消耗盐酸18.00 mL,写出该反应的离子方程式_______ ,通过实验,测出 溶液的物质的量浓度为
溶液的物质的量浓度为_______ mol·L-1。
③第三步:求算样品中纯碱晶体的质量分数。
根据实验数据,欲求算纯碱晶体( )的质量分数,还需要通过称量得到的物理量是
)的质量分数,还需要通过称量得到的物理量是_______ 。
④通过计算,该同学得出的实验结果偏高,可能的原因是_______ 。
A.未用蒸馏水洗涤烧杯内壁
B.容量瓶中原有少量水
C.摇匀后发现液面低于刻度线,补加少量水
D.定容时俯视液面
温度 溶解度/s 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 35.9 | 36.1 | 36.4 |
| 7.3 | 13.6 | 24.9 | 52.9 | 70.8 |
(2)为检验纯碱样品中是否含有NaCl,应使用的试剂是_______。
| A. | B.稀盐酸、 |
| C.稀 | D.稀 |
Ⅱ.为测定纯碱样品(含NaCl杂质)的质量分数
(3)实验过程中使用到下列仪器,其中使用前必须检查是否漏水的有_______。
A.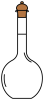 | B.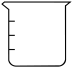 | C. | D. |
该同学配制溶液的部分过程如下,请写出中间步骤B的具体内容。
A.将蒸馏水缓慢注入容量瓶,直到液面接近刻度线l~2cm处。
B……
C.将容量瓶盖好,颠倒摇匀。
将溶液转移至容量瓶时用到了玻璃棒,其作用是
②第二步:测定溶液浓度。
该同学量取样品溶液20.00 mL,与0.160 mol·L-1稀盐酸反应至完全转化为
③第三步:求算样品中纯碱晶体的质量分数。
根据实验数据,欲求算纯碱晶体(
④通过计算,该同学得出的实验结果偏高,可能的原因是
A.未用蒸馏水洗涤烧杯内壁
B.容量瓶中原有少量水
C.摇匀后发现液面低于刻度线,补加少量水
D.定容时俯视液面
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网




