解答题-实验探究题 适中0.65 引用1 组卷123
草酸亚铁晶体(FeC2O4∙2H2O)是一种浅黄色固体,是生产锂电池的原材料,也常用作分析试剂、显影剂及制药工业。它难溶于水,不溶于丙酮,熔点为160℃,受热易分解。回答下列问题:
(1)制备草酸亚铁晶体:称取10g(NH4)2Fe(SO4)2∙6H2O于200mL烧杯中,加入适量蒸馏水溶解,再加入8mL饱和H2C2O4溶液,继续滴加5滴2 硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。
硫酸酸化,不断搅拌,加热至沸腾,待有浅黄色固体析出时,静置,抽滤,洗涤,晾干。
①不断搅拌的作用是_______ 。
②制备草酸亚铁的化学方程式为_______ 。
③洗涤草酸亚铁晶体时,先用水洗,再用丙酮洗涤2~3次,原因是_______ 。
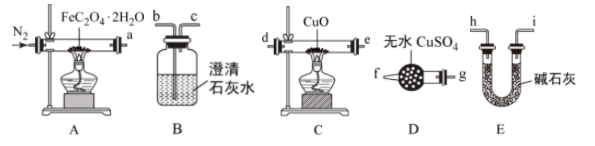
(2)查阅资料获知:草酸亚铁晶体在600℃左右发生分解反应,产物中有H2O、CO、CO2三种气体,某化学兴趣小组拟利用如图装置验证草酸亚铁晶体受热分解的气体产物。

实验时,合理的装置(可重复选择)连接顺序是A→_______ →尾气吸收。
(3)工业中制得的草酸亚铁晶体(FeC2O4·2H2O)中常有FeSO4杂质,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品溶于稀硫酸中配成250mL溶液,取25mL溶液滴定,消耗c1 mol/L高锰酸钾溶液V1mL
Ⅱ.向反应后溶液加入锌粉,酸化,消耗c1 mol/L高锰酸钾溶液V2mL
①滴定时应将高锰酸钾溶液加入_______ (填“酸式”或“碱式”)滴定管中;在规格为50.00mL的滴定管中,若起始读数为15.00mL,此时滴定管中溶液实际体积_______ (填大于,小于或等于)35.00mL
②第二次达到滴定终点的现象是_______
③该样品的纯度为_______ ;若配制溶液时亚铁离子被氧化,则测定结果将_______ (填“偏高”“偏低”或“不变”)
(1)制备草酸亚铁晶体:称取10g(NH4)2Fe(SO4)2∙6H2O于200mL烧杯中,加入适量蒸馏水溶解,再加入8mL饱和H2C2O4溶液,继续滴加5滴2
①不断搅拌的作用是
②制备草酸亚铁的化学方程式为
③洗涤草酸亚铁晶体时,先用水洗,再用丙酮洗涤2~3次,原因是
(2)查阅资料获知:草酸亚铁晶体在600℃左右发生分解反应,产物中有H2O、CO、CO2三种气体,某化学兴趣小组拟利用如图装置验证草酸亚铁晶体受热分解的气体产物。

实验时,合理的装置(可重复选择)连接顺序是A→
(3)工业中制得的草酸亚铁晶体(FeC2O4·2H2O)中常有FeSO4杂质,采用KMnO4滴定法测定该样品的组成,实验步骤如下:
Ⅰ.取mg样品溶于稀硫酸中配成250mL溶液,取25mL溶液滴定,消耗c1 mol/L高锰酸钾溶液V1mL
Ⅱ.向反应后溶液加入锌粉,酸化,消耗c1 mol/L高锰酸钾溶液V2mL
①滴定时应将高锰酸钾溶液加入
②第二次达到滴定终点的现象是
③该样品的纯度为
22-23高三上·江西·期中
类题推荐
草酸亚铁晶体( )是生产锂电池电极的原料,它呈浅黄色,难溶于水,受热易分解。某小组设计实验制备草酸亚铁晶体并测定其纯度。
)是生产锂电池电极的原料,它呈浅黄色,难溶于水,受热易分解。某小组设计实验制备草酸亚铁晶体并测定其纯度。
实验(一)制备草酸亚铁晶体并探究其热分解产物。
①称取5.0g ,放入如下图装置的三颈烧瓶中,加入10滴左右1.0mol·L-1硫酸溶液和15mL蒸馏水,加热溶解。
,放入如下图装置的三颈烧瓶中,加入10滴左右1.0mol·L-1硫酸溶液和15mL蒸馏水,加热溶解。
③待浅黄色晶体沉淀后,抽滤、洗涤、干燥得到晶体。
(1)仪器A的作用是_______ ,此实验中三颈烧瓶的规格宜选择_______ (填字母)。
a.50mL b.100mL c.250mL d.500mL
(2)用98.3%硫酸配制1.0mol·L-1稀硫酸,不需要选用的仪器是_______(填字母)。
(3) 在空气中易变质,可以检验其是否变质的试剂是
在空气中易变质,可以检验其是否变质的试剂是_______ (填字母)。
A.苯酚溶液 B. 溶液 C.KSCN溶液 D.
溶液 C.KSCN溶液 D. 溶液
溶液
从结构角度分析,其易变质的原因是_______ 。
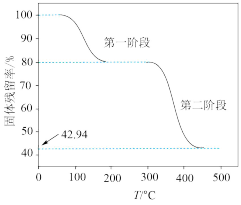
(4)在氩气中, 的热重曲线如图所示。已知:
的热重曲线如图所示。已知: 。
。_______ 。
实验(二)测定产品纯度。
称取w g产品溶于稀硫酸中,配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,用标准c mol·L-1 KMnO4溶液滴定至终点,消耗滴定液V mL。滴定反应为 (未配平)。
(未配平)。
(5)该产品含Fe元素质量分数为_______ (填百分式)。若酸式滴定管没有用待装液润洗,测得结果_______ (填“偏高”“偏低”或“无影响”)。
实验(一)制备草酸亚铁晶体并探究其热分解产物。
①称取5.0g

③待浅黄色晶体沉淀后,抽滤、洗涤、干燥得到晶体。
(1)仪器A的作用是
a.50mL b.100mL c.250mL d.500mL
(2)用98.3%硫酸配制1.0mol·L-1稀硫酸,不需要选用的仪器是_______(填字母)。
A. | B.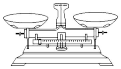 | C.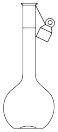 | D.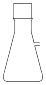 |
(3)
A.苯酚溶液 B.
从结构角度分析,其易变质的原因是
(4)在氩气中,
实验(二)测定产品纯度。
称取w g产品溶于稀硫酸中,配制成250mL溶液,准确量取25.00mL配制溶液于锥形瓶中,用标准c mol·L-1 KMnO4溶液滴定至终点,消耗滴定液V mL。滴定反应为
(5)该产品含Fe元素质量分数为
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网