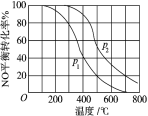
解答题-原理综合题 适中0.65 引用1 组卷84
硫酸是一种重要的基本化工产品。
(1)接触法制硫酸的第一步是将黄铁矿(FeS2)和氧气加入沸腾炉中发生如下反应:4FeS2(s)+11O2(g)= 2Fe2O3(s)+8SO2(g) ΔH < 0 ;为了提高黄铁矿的利用率,可以采取的措施是_______ ,_______ (任答两点)。
(2)将SO2和O2通入接触室,在催化剂(V2O5)的作用下发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-98 kJ·mol-1。回答下列问题:
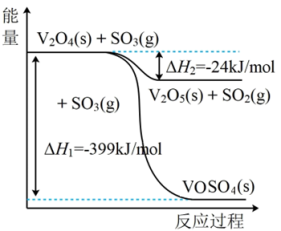
①钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:_______ 。
②能说明2SO2(g)+O2(g)⇌2SO3(g)在绝热恒容条件下已达到平衡状态的是_______ 。
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.体系温度不再改变 D.容器内密度保持不变
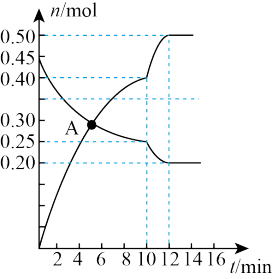
③400℃时,若向2 L体积恒定的密闭容器中充入物质的量之比是2∶1的SO2和O2发生反应,其中O2、SO3物质的量随时间变化的曲线如图所示。图中A点v正_______ (填“>”“<”或“=”)v逆;达平衡后,反应前和反应后的压强比是_______ ;第10 min时,外界改变的条件可能是_______ (填字母)。
A.加合适催化剂 B.增大O2的物质的量 C.减小SO2的物质的量
D.升高温度 E.降低温度 F.充入Ar
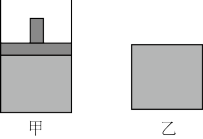
(3)将1mol的SO2和1molO2分别充入下面的两个体积相同的容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。达平衡时SO2的转化率甲_______ 乙(填“>”“<”或“=”)。
(1)接触法制硫酸的第一步是将黄铁矿(FeS2)和氧气加入沸腾炉中发生如下反应:4FeS2(s)+11O2(g)= 2Fe2O3(s)+8SO2(g) ΔH < 0 ;为了提高黄铁矿的利用率,可以采取的措施是
(2)将SO2和O2通入接触室,在催化剂(V2O5)的作用下发生如下反应:2SO2(g)+O2(g)⇌2SO3(g) ΔH=-98 kJ·mol-1。回答下列问题:
①钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为:

②能说明2SO2(g)+O2(g)⇌2SO3(g)在绝热恒容条件下已达到平衡状态的是
A.v(SO3)=2v(O2) B.容器内压强保持不变
C.体系温度不再改变 D.容器内密度保持不变
③400℃时,若向2 L体积恒定的密闭容器中充入物质的量之比是2∶1的SO2和O2发生反应,其中O2、SO3物质的量随时间变化的曲线如图所示。图中A点v正

A.加合适催化剂 B.增大O2的物质的量 C.减小SO2的物质的量
D.升高温度 E.降低温度 F.充入Ar
(3)将1mol的SO2和1molO2分别充入下面的两个体积相同的容器中,已知甲容器有活塞可以上下移动,乙容器体积固定,在相同的温度、压强下开始发生反应,在反应过程中维持体系温度不变。达平衡时SO2的转化率甲

22-23高二上·云南玉溪·期中
类题推荐
组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网