解答题-原理综合题 困难0.15 引用2 组卷831
二氧化碳甲烷化助力我国2060年前实现“碳中和”,其中涉及的主要反应如下:
反应Ⅰ:CO₂(g)+4H₂(g) CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
CH₄(g)+2H₂O(g) △H=-164.7kJ·mol⁻¹
反应Ⅱ:CO₂(g)+H₂(g) CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
CO(g)+H₂O(g) △H=+41.2kJ·mol⁻¹
回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
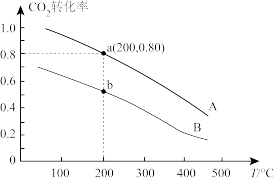
(2)动力学研究:在多个1L恒容密闭装置中,分别充入1molCO₂和 发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为
发生上述反应Ⅰ,在不同温度下反应到10分钟时,测得H₂转化率与温度关系如图1所示。已知该反应的速率方程为 ,
, ,其中
,其中 、
、 为速率常数,只受温度影响。
为速率常数,只受温度影响。

①图1中,至a点的H₂平均反应速率为_______  。
。
②图1中,v(a)逆_______ v(c)逆(填“>”、“=”或“<”)。
③图1中c点的 对应的是图2中的
对应的是图2中的_______ 点。
④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是
______ 。
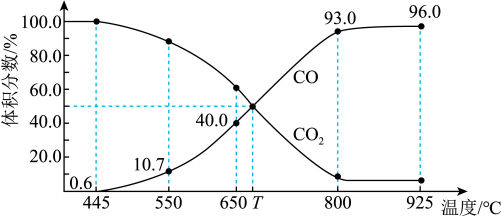
(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是_______ (填序号)。
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是_______ (填写含碳元素物质的化学式)的物质的量与温度的关系,简述其在温度段500K~800K物质的量增大的原因_______ 。
③800K时,反应Ⅱ的平衡常数为_______ (计算结果保留两位有效数字)。
反应Ⅰ:CO₂(g)+4H₂(g)
反应Ⅱ:CO₂(g)+H₂(g)
回答下列问题:
(1)由热化学方程式可知,反应Ⅰ属于反应_______(填写序号)
| A.高温自发 | B.低温自发 | C.恒自发 | D.恒不自发 |

①图1中,至a点的H₂平均反应速率为
②图1中,v(a)逆
③图1中c点的
④图1中a点的v正,v逆与a点的K(平衡常数)、Q(浓度商)的关系是
(3)热动力学研究:向10L的恒压密闭装置中充入5mol CO₂和20mol H₂,在不同温度下同时发生上述反应Ⅰ和反应Ⅱ,得到平衡时各含碳物质的物质的量n(X)与温度T的关系如下图所示。

①当反应Ⅰ和反应Ⅱ均达到化学平衡状态时,维持温度不变,压缩装置体积,则反应Ⅱ的平衡移动方向是
A.正向移动 B.逆向移动 C.不移动 D.无法确定
②曲线Z表示的是
③800K时,反应Ⅱ的平衡常数为
22-23高三上·湖北黄冈·期中
类题推荐
CO2是一种温室气体,对人类的生存环境产生巨大的影响,将CO2作为原料转化为有用化学品,对实现碳中和及生态环境保护有着重要意义。
I、工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为2NH3(1)+CO2(l)=H2O(l)+NH2CONH2(1) ΔH=_____ kJ/mol。
(2)在恒容密闭容器中发生反应: 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH<0。下列说法错误的是
Ⅱ.由CO2与H2制备甲醇是当今研究的热点之一。
(3)在一定条件下,向0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH3=- 50kJ·mol-1
CH3OH(g)+H2O(g) ΔH3=- 50kJ·mol-1

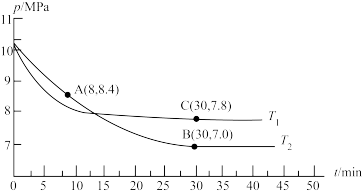
①若x=1、y=3, 测得在相同时间内,不同温度下H2的转化率如图1所示,点a_____ 填“是”或“否”)达到平衡。T2时,若起始压强为10atm, Kp=_____ atm-2(结果保留一位小数,Kp为以分压表示的平衡常数,分压=总压 ×物质的量分数)。
②已知速率方程v正 =k正 c(CO2)·c3(H2), v逆 =k逆c(CH3OH)·c(H2O), k正、k 逆是速率常数,只受温度影响,图2表示速率常数k正、k逆的对数lgk与温度的倒数 之间的关系, A、B、D、E分别代表图1中a点、c点的速率常数,其中点
之间的关系, A、B、D、E分别代表图1中a点、c点的速率常数,其中点_____ (填A或B或D或E)表示c点的lgk逆。

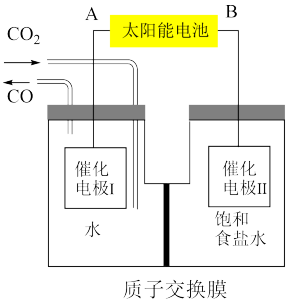
(4)我国科学家设计出如图装置实现CO2的转化,可有效解决温室效应及能源问题,总反应为CO2+NaCl CO+NaClO(忽略气体 在溶液中的溶解及溶液的体积变化)。
CO+NaClO(忽略气体 在溶液中的溶解及溶液的体积变化)。
电极Ⅱ的电极反应式为_______ 。电解结束后,电极Ⅱ所在电极室溶液pH ___________ (填“变大”或“变小”)
I、工业上以CO2和NH3为原料合成尿素,在合成塔中存在如下转化:

(1)液相中,合成尿素的热化学方程式为2NH3(1)+CO2(l)=H2O(l)+NH2CONH2(1) ΔH=
(2)在恒容密闭容器中发生反应: 2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) ΔH<0。下列说法错误的是
| A.反应在任何温度下都能自发进行 |
| B.增大CO2的浓度,有利于NH3的转化率增大 |
| C.当混合气体的密度不再发生改变时反应达平衡状态 |
| D.充入He,压强增大,平衡向正反应移动 |
Ⅱ.由CO2与H2制备甲醇是当今研究的热点之一。
(3)在一定条件下,向0.5L恒容密闭容器中充入xmolCO2和ymolH2,发生反应CO2(g)+3H2(g)

①若x=1、y=3, 测得在相同时间内,不同温度下H2的转化率如图1所示,点a
②已知速率方程v正 =k正 c(CO2)·c3(H2), v逆 =k逆c(CH3OH)·c(H2O), k正、k 逆是速率常数,只受温度影响,图2表示速率常数k正、k逆的对数lgk与温度的倒数

(4)我国科学家设计出如图装置实现CO2的转化,可有效解决温室效应及能源问题,总反应为CO2+NaCl
电极Ⅱ的电极反应式为

组卷网是一个信息分享及获取的平台,不能确保所有知识产权权属清晰,如您发现相关试题侵犯您的合法权益,请联系组卷网